






- 第三章第1节铁及其化合物第3课时 课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 10 次下载
- 第三章第1节铁及其化合物第4课时 课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 1 次下载
- 第四章第1节原子结构与元素周期表第1课时 课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 3 次下载
- 第四章第1节原子结构与元素周期表第2课时 课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 3 次下载
- 第四章第1节原子结构与元素周期表第3课时碱金属课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 3 次下载
2020-2021学年第二节 金属材料教课内容ppt课件
展开1.氯化铁与铁粉反应2.覆铜板制备原理3.氯化铁与硫氰化钾4.硫酸亚铁与锌片5.硫酸亚铁与氯水6.硫酸亚铁与酸性高锰酸钾7.硫酸亚铁与双氧水8.实验室保存硫酸亚铁
合金是由两种或两种以上的金属或金属与非金属熔合而成的具有金属特性的物质。
生活中用到的金属材料是纯金属较多还是合金较多?
合金的性能比纯金属更优良
常见合金的硬度会比其成分金属大,合金的熔点一般比成分金属低。
金属材料 阅读课文
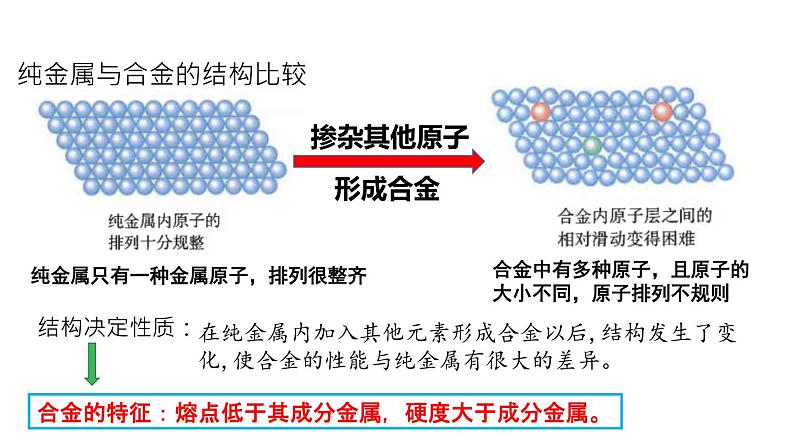
纯金属与合金的结构比较
在纯金属内加入其他元素形成合金以后,结构发生了变化,使合金的性能与纯金属有很大的差异。
合金的特征:熔点低于其成分金属,硬度大于成分金属。
合金中有多种原子,且原子的大小不同,原子排列不规则
纯金属只有一种金属原子,排列很整齐
1.生铁的熔点是1100 ℃~1200 ℃,则可推断纯铁的熔点是( )A.1085 ℃ B.1160 ℃C.1200 ℃ D.1535 ℃
解析:合金的熔点低于成分金属的熔点。生铁为合金,熔点是1100℃~1200 ℃,铁的熔点应高于1200 ℃,D正确。
(1)合金一定是不同金属熔合而成的具有金属特性的化合物( )(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高( )(3)铁、铬、镍熔合成不锈钢是化学变化( )(4)生铁中的铁与纯铁的化学性质不同( )(5)地震灾区重建要使用大量钢材,钢材是合金( )
已知铜的熔点为1 083 ℃,钠的沸点为883 ℃,试问铜与钠能否形成合金?提示 不能。当铜开始熔化时,钠已经气化,所以二者不能形成合金。
铝是地壳中含量最高的金属元素
铝是一种活泼金属,常温下能被空气中的氧气氧化,写出该反应的化学方程式。
4Al+3O2 ===2Al2O3
铝容易被空气氧化,但为什么人们日常生活中总喜欢使用铝合金制造的物品呢?
铝表面会与空气中氧气生成一层致密的氧化铝薄膜,这层膜起着保护内部金属的作用。
铝箔熔化,表面失去光泽,熔化的铝并不滴落,好象有一层膜兜着
因为铝表面有一层氧化膜保护了铝。构成膜的氧化铝(Al2O3)的熔点很高,没有熔化,包在外面使熔化的液态铝不会滴落下来。
活泼的金属在空气中易与氧气反应,产生有一层氧化物。有的氧化膜疏松,不能保护内层金属,如铁和钠等。有的氧化物致密,可以保护内层金属不被继续氧化,如镁和铝等。
Al2O3+6HCl=2AlCl3+3H2O
2Al+6HCl=2AlCl3+3H2↑
Al2O3+2NaOH=2NaAlO2+H2O
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【思考与交流】在上面的实验中,我们还观察到,反应开始的时候气泡很少,后期才有大量气泡,产生这种现象的原因是什么?
实验表明,铝表面的保护膜和铝均能与盐酸发生反应。
实验表明,铝表面的保护膜和铝均能与氢氧化钠发生反应。
铝、氧化铝、氢氧化铝与酸或碱的反应
2Al+2NaOH+2H2O=3H2↑+2NaAlO2
2、氧化铝(两性氧化物)
3、氢氧化铝(两性氢氧化物)
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
2Al + 2OH- + 2H2O = 3H2↑+2AlO2-
既能与酸反应生成盐和水,也能与碱反应生成盐和水的氧化物(或氢氧化物),叫做两性氧化物(或两性氢氧化物)。如Al2O3 Al(OH)3
1.铝是活泼金属,但在日常生活中铝制品却能稳定存在,原因是什么?
提示 常温下铝与氧气反应,在铝制品表面形成致密的氧化铝薄膜,保护铝不被腐蚀。
2.向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中发生的离子反应有______________________________________________________________________________________________________________________________________________________________________________ 。
1.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是
2.下列说法正确的是A.Al2O3难溶于水,不与水反应,所以它不是Al(OH)3对应的氧化物B.因为Al2O3是金属氧化物,所以它是碱性氧化物C.Al2O3能跟所有的酸、碱溶液反应D.Al2O3能跟强酸、强碱溶液反应
解析 甲、乙两烧杯中含HCl、NaOH的物质的量都为0.4 ml,根据化学方程式:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑可知,5.4 g(即0.2 ml)Al分别与盐酸和NaOH溶液反应时,盐酸不足量而NaOH过量,故Al与盐酸反应生成0.2 ml H2,与NaOH溶液反应生成0.3 ml H2,其体积比为2∶3。
14.甲、乙两个烧杯中分别盛有100 mL 4.0 ml·L-1的盐酸和100 mL 4.0 ml·L-1 NaOH溶液,向两个烧杯中均加入5.4 g铝粉,在相同状况下产生气体的体积比为A.1∶1 B.2∶3 C.3∶2 D.3∶1
2.下列不属于新型合金材料的是A.储氢合金 B.形状记忆合金C.不锈钢 D.镍钴耐热合金
3.合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。(1)下列物质不属于合金的是 (填字母,下同)。A.明矾 B.硬铝 C.生铁 D.青铜
6.除去镁粉中的少量铝粉,可选用的是A.稀硫酸 B.氢氧化钠溶液C.水 D.稀盐酸
高中人教版 (2019)第三章 铁 金属材料第二节 金属材料授课课件ppt: 这是一份高中人教版 (2019)第三章 铁 金属材料第二节 金属材料授课课件ppt,共40页。PPT课件主要包含了第二节金属材料,新型合金,1mol,nH2SO4,mol,V672L等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 金属材料教学课件ppt: 这是一份人教版 (2019)必修 第一册第二节 金属材料教学课件ppt,共20页。PPT课件主要包含了学习目标,特别注意,课堂小练,新型合金,记忆合金等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 金属材料图片ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 金属材料图片ppt课件,共24页。PPT课件主要包含了测试工程师,铁合金,铝和铝合金,铝及氧化铝,氧化物,新型合金等内容,欢迎下载使用。













