


人教版 (新课标)选修4 化学反应原理第一节 原电池集体备课课件ppt
展开1.以铜锌电池为例,熟悉原电池的工作原理。
2.会正确判断原电池的正极和负极。
3.掌握原电池电极反应式的书写和方法。
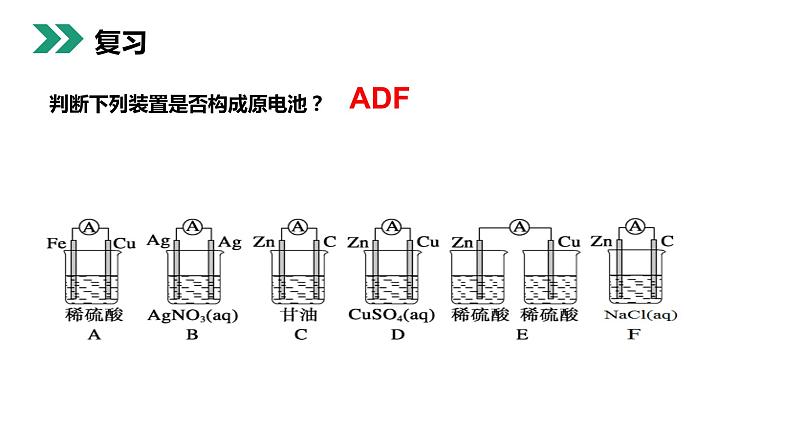
判断下列装置是否构成原电池?
一、构成原电池的条件:
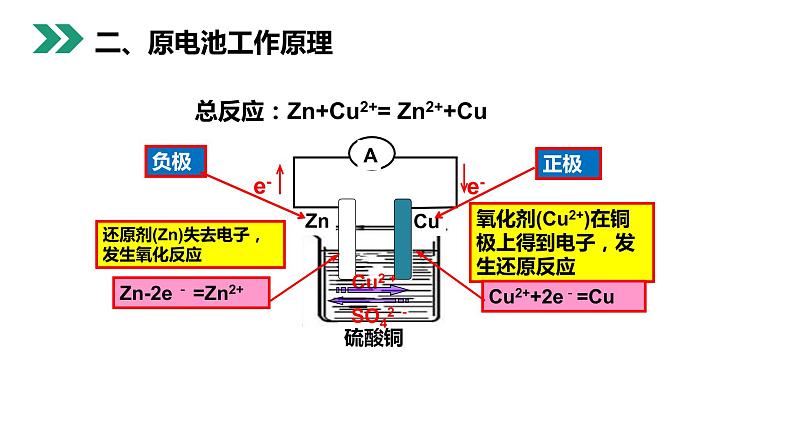
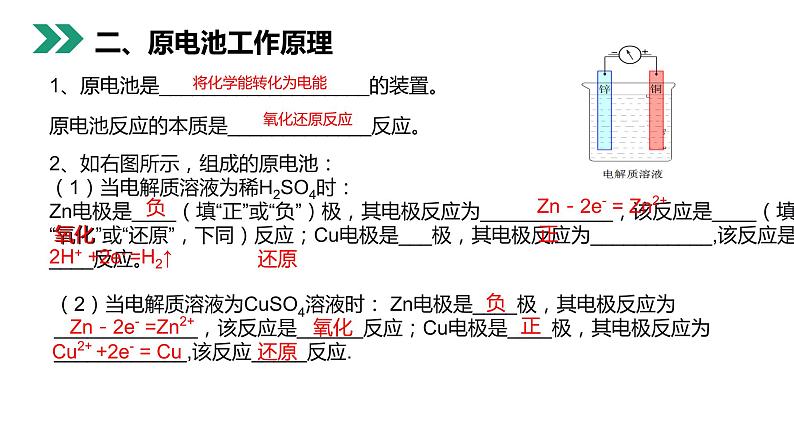
1、原电池是___________________的装置。原电池反应的本质是_____________反应。
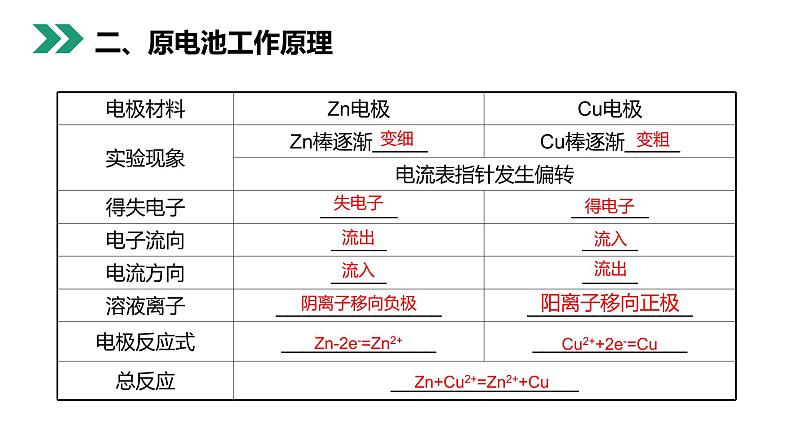
2、如右图所示,组成的原电池:(1)当电解质溶液为稀H2SO4时:Zn电极是____(填“正”或“负”)极,其电极反应为____________,该反应是____(填“氧化”或“还原”,下同)反应;Cu电极是___极,其电极反应为___________,该反应是____反应。
(2)当电解质溶液为CuSO4溶液时: Zn电极是____极,其电极反应为_____________,该反应是______反应;Cu电极是____极,其电极反应为____________,该反应_____反应.
Zn-2e- = Zn2+
2H+ +2e- =H2↑
Zn-2e- =Zn2+
Cu2+ +2e- = Cu
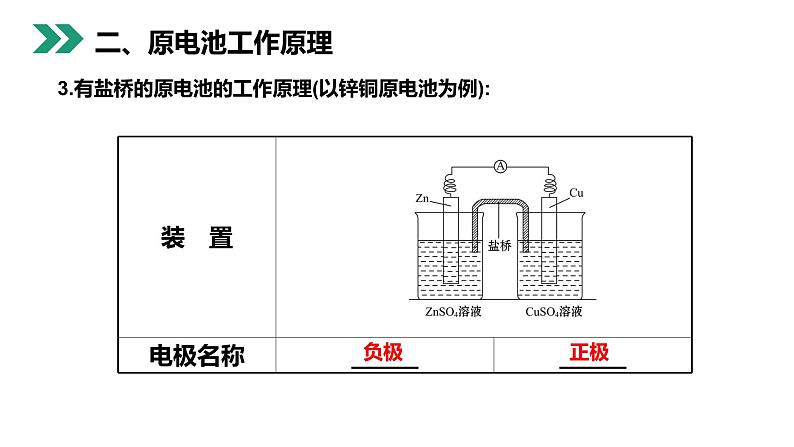
3.有盐桥的原电池的工作原理(以锌铜原电池为例):
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+=Zn2++Cu
盐桥的作用:(1)成分:含有____________的琼脂。(2)离子移动方向:Cl-移向_____________(负极区),K+移向_____________(正极区)。(3)作用:使两个半电池形成通路,并保持两溶液的电中性。
利用反应原理Cu+2Ag+=Cu2++2Ag设计一个能得到稳定电流的原电池装置,画出装置简图,并标注电极及电解质溶液
1.加快化学反应速率:构成原电池的反应速率比直接接触的反应速率___。如实验室制H2时,粗锌比纯锌与稀硫酸反应快,或向溶液中滴入几滴CuSO4溶液,反应加快。
2.比较金属的活动性强弱:对于酸性电解质,一般是作负极的金属活动性___,作正极的金属活动性较___。
3.设计原电池:(1)理论上:自发进行的_________反应,可以设计成原电池。(2)外电路。负极—_____性较强的物质被_____;正极—_____性较强的物质被_____
a、b、c、d四块金属浸入稀硫酸中,用导线两两相连组成原电池,若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时, c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序为 ( ) A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
1. 一般电极反应式的书写方法(1)定电极,标得失。按照负极发生氧化反应,正极发生还原反应,判断出电极反应产物,找出得失电子的数量。(2)看环境,配守恒。电极产物在电解质溶液的环境中,应能稳定存在,如碱性介质中生成的H+应让其结合OH-生成水。电极反应式要依据电荷守恒和质量守恒、得失电子守恒等加以配平。(3)两式加,验总式。两电极反应式相加,与总反应方程式对照验证。
2. 已知总反应式,书写电极反应式(1)分析化合价,确定正极、负极的反应物与产物。(2)在电极反应式的左边写出得失电子数,使得失电子守恒。(3)根据质量守恒配平电极反应式。(4)
3. 原电池的设计从理论上讲,任何一个自发的氧化还原反应都可以设计成原电池。关键是选择合适的电解质溶液和两个电极。(1)电解质溶液:一般能与 反应,或者溶解在溶液中的物质(如O2)与 反应。(2)电极材料:一般较活泼的金属作 ,较不活泼的金属或非金属导体作 。
1. 关于原电池的叙述中正确的是 ( )A.构成原电池的两极必须是两种不同金属B.原电池是将化学能转化为电能的装置C.原电池工作时总是负极溶解,正极上有物质析出D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原
2.下图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
卡片上的描述合理的是( )A.①②③ B.③④⑤ C.①⑤⑥ D.②③④
高中化学第四章 电化学基础综合与测试教学演示课件ppt: 这是一份高中化学第四章 电化学基础综合与测试教学演示课件ppt,共19页。PPT课件主要包含了学习目标,电解池,离子的运动方向,电子的运动方向,1阳极,还原反应,氧化反应,阳离子,阴离子,电解过程分析步骤等内容,欢迎下载使用。
高中人教版 (新课标)第三章 水溶液中的离子平衡综合与测试授课ppt课件: 这是一份高中人教版 (新课标)第三章 水溶液中的离子平衡综合与测试授课ppt课件,共26页。PPT课件主要包含了学习目标,指示剂的选择,酸碱中和滴定,c酸V酸c碱V碱,c待=,c标·V标,仪器及其使用,酸式滴定管,碱式滴定管,2滴定管的构造等内容,欢迎下载使用。
《pH的相关计算》人教版高二化学选修4PPT课件: 这是一份人教版 (新课标)选修4 化学反应原理本册综合课前预习ppt课件,共25页。PPT课件主要包含了学习目标,总的原则,-lgcH+,-lgnc,稀释10倍,104molL,稀释100倍,105molL,稀释10000倍,强酸或强碱稀释等内容,欢迎下载使用。













