




高中化学第四章 电化学基础综合与测试教学演示课件ppt
展开
这是一份高中化学第四章 电化学基础综合与测试教学演示课件ppt,共19页。PPT课件主要包含了学习目标,电解池,离子的运动方向,电子的运动方向,1阳极,还原反应,氧化反应,阳离子,阴离子,电解过程分析步骤等内容,欢迎下载使用。
1、了解氯碱工业,掌握电解饱和的反应原理。
2、掌握电镀的原理,粗铜精炼。
3、掌握电化学原理保护金属的方法。
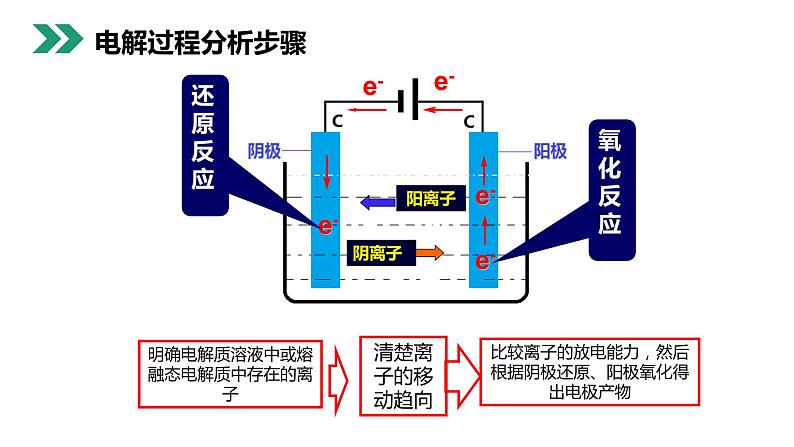
电流通过电解质溶液或熔融状态的电解质,在阴阳两极引起氧化还原的过程。
把电能转化成化学能的装置。
异性相吸:阳离子运动到阴极阴离子运动到阳极
电子从外加电源的负极流到阴极再从电解池的阳极流回外加电源的正极
5、电极反应及放电顺序
S2->I->Br->Cl->OH->含氧酸根
如:4OH- — 4e-= 2H2O+O2↑
(2)阴极发生还原反应,氧化 性强的先反应
Ag+ >Fe3+ >Cu2+>H+ >Pb2+ >Fe2+>Zn2+ >Al3+>…
如果是活性阳极(除铂、金、石墨外):活性阳极发生氧化反应。
如果是惰性阳极(如铂、金、石墨):溶液中的阴离子发生氧化反应,阴离子放电顺序为
比较离子的放电能力,然后根据阴极还原、阳极氧化得出电极产物
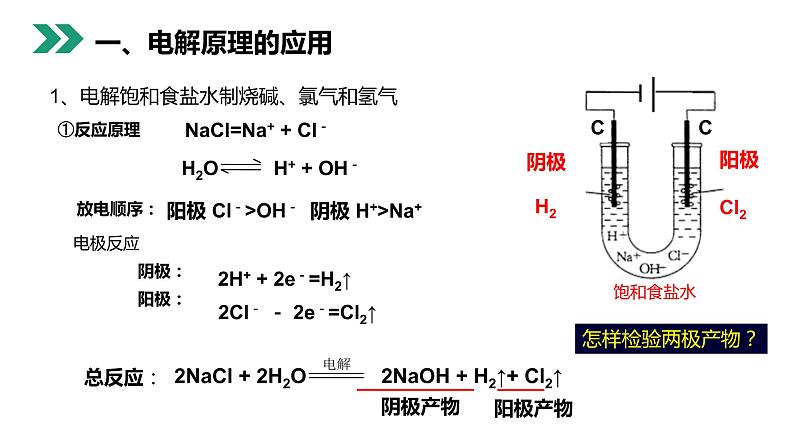
1、电解饱和食盐水制烧碱、氯气和氢气
NaCl=Na+ + Cl-
阳极 Cl->OH-
电极反应 阴极: 阳极:
2H+ + 2e-=H2↑
2Cl- - 2e-=Cl2↑
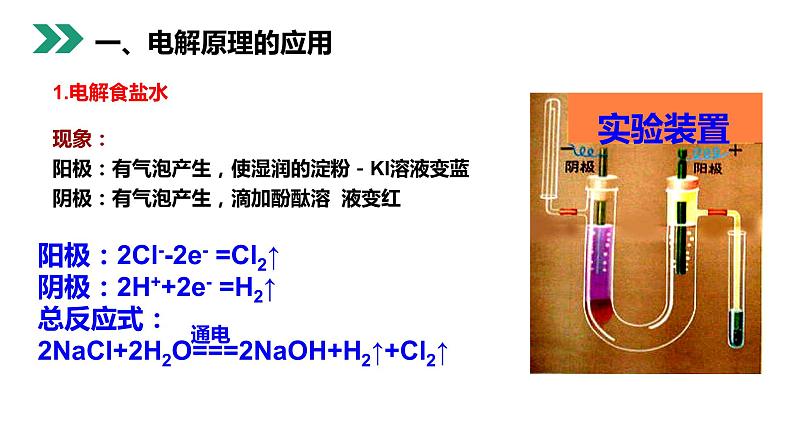
现象:阳极:有气泡产生,使湿润的淀粉-KI溶液变蓝阴极:有气泡产生,滴加酚酞溶 液变红
H2O(含少量NaOH)
用润湿的KI淀粉试纸靠近阳极,现象试纸变蓝,证明有氯气生成。
(2)在阴极附近加入酚酞,现象是?用平衡理论解释?
阴极附近生成氢氧化钠溶液,遇到酚酞变红。
思考(1)检验阳极产物的方法是?
(3)生产设备名称:离子交换膜电解槽 阴极:碳钢 阳极:钛 阳离子交换膜:只允许阳离子通过(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。 (4)离子交换膜的作用: a、防止氢气和氯气混合而引起爆炸; b、避免氯气和氢氧化钠反应生成 ,而影响氢氧化钠的产量。
氯碱工业:离子交换膜法制烧碱
粗盐的成份: 泥沙、Ca2+、Mg2+、Fe3+、SO42-杂质,会与碱性物质反应产生沉淀,损坏离子交换膜
含少量Ca2+.Mg2+
将电能转变成化学能的装置。
应用电解原理在某些金属表面镀上一层其它金属的装置。
①两电极接直流电源②电极插入电解质溶液③形成闭合回路
①镀层金属接电源正极待镀金属接电源负极②电镀液须含有镀层金属的离子
阳极:电源正极相连阴极:电源负极相连
阳极:镀层金属;阴极:镀件
阳极:氧化反应阴极:还原反应
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极②电解质溶液须待提纯金属的离子
阳极:不纯金属;阴极:纯金属
电解池、电解精炼池、电镀池的比较
2. a 、b哪一极为正极?
1.若要给铁叉镀锌, a极选用什么材料? 选择何种溶液?
3. 若要给铁叉镀金, a极选用什么材料? 选择何种溶液?
5.金属性强弱的判断 已知①M+N2+=M2++N ②Pt极电解相同浓度P和M的硫酸盐,阴极先析出M ③N与E有导线相连放入E的硫酸盐溶液,电极反应:E2++2e-=E,N-2e-=N2+,则四种金属活泼性由强到弱为
工业上采用Fe、C为电极电解K2MnO4溶液制KMnO41.电解时,应以 作阴极,电解过程中阴极附近溶液pH将会 , 2.阳极反应式为 , 3.总电解反应式为 .
2K2MnO4+2H2O=2KMnO4+2KOH+H2↑
答案:Fe 增大 MnO42—_e- =MnO4—
例1 铂电极电解1LCu(NO3)2和KNO3混合溶液,通电一段时间,两极均产生11.2L(S.T.P)气体.求电解后溶液的pH,并确定析出铜的物质的量.
解析:阳极 4OH--4e-=2H2O+O2↑ 阴极 Cu2++2e- =Cu↓ 2H++2e- =H2↑ 阳极转移电子的物质的量为: 0.5×4 = 2ml,消耗4OH- 2ml,即产生H+ 2ml. 阴极生成0.5mlH2,消耗H+ 1ml;所以溶液中C(H+)=1ml/L pH=0 生成H2转移的电子:0.5 ×2=1ml,故还有1mle- 用于还原Cu2+,可析出铜为0.5ml.
电解计算——电子守恒法
例2 用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为( ) A.1ml/L B.2ml/L C.3ml/L D.4ml/L
阳极O2为0.1ml,电子为0.4ml
则H2为0.1ml,所以Cu为0.1ml,浓度为A
相关课件
这是一份2020-2021学年第二节 电解池教学课件ppt,文件包含人教版化学选修一422《电解原理的应用》课件pptx、人教版化学选修一422《电解原理的应用》教学设计docx等2份课件配套教学资源,其中PPT共18页, 欢迎下载使用。
这是一份高中人教版 (新课标)第四章 电化学基础综合与测试课文内容ppt课件,共22页。PPT课件主要包含了学习目标,⑴两个电极,⑶形成闭合回路,温故知新,有关电解,实验探究,以电解氯化铜溶液为例,离子放电顺序,CuCl2,CuCl2溶液等内容,欢迎下载使用。
这是一份高中化学第三节 盐类的水解说课课件ppt,共21页。PPT课件主要包含了学习目标,生活小常识,纯碱是什么,为什么叫纯碱,“纯碱”,盐类的分类,强酸弱碱盐,强碱弱酸盐,强酸强碱盐,操作方法等内容,欢迎下载使用。










