





初中化学人教版 (五四制)八年级全册第三单元 物质构成的奥秘课题1 分子和原子教课内容ppt课件
展开
这是一份初中化学人教版 (五四制)八年级全册第三单元 物质构成的奥秘课题1 分子和原子教课内容ppt课件,共21页。PPT课件主要包含了不带电,原子的构成,一个该原子的质量,核外电子的运动规律,核内质子数,电子层,电子层上的电子数,原子结构示意图,离子的表示方法等内容,欢迎下载使用。
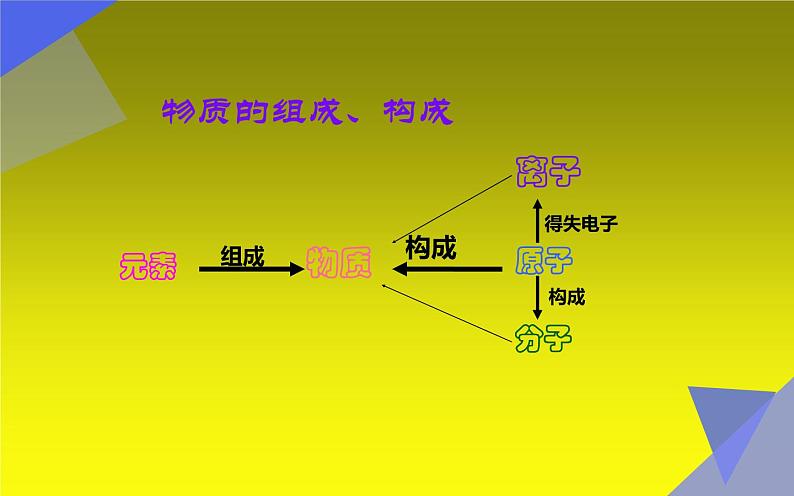
概念:分子是保持物质化学性质的最小粒子。
1.由分子构成的物质,在发生化学变化时,分子被破坏, 原物质的化学性质不再保持.
2.保持是指构成物质的每一个分子和该物质的化 学性质完全相同
3.保持物质的化学性质的粒子除了分子外,还有其他粒子,如原子﹑离子.
1.分子很小2.分子在不断运动3.分之间有间隔4.同种分子化学性质相同,不同种分子化学性质不同
概念:化学变化中的最小微粒
性质:1.原子很小 2.原子在不断运动 3.原子间有间隔 4.同种原子化学性质相同,不同种原子化学性质不同
化学变化的微观实质:分子分裂原子的重新组合
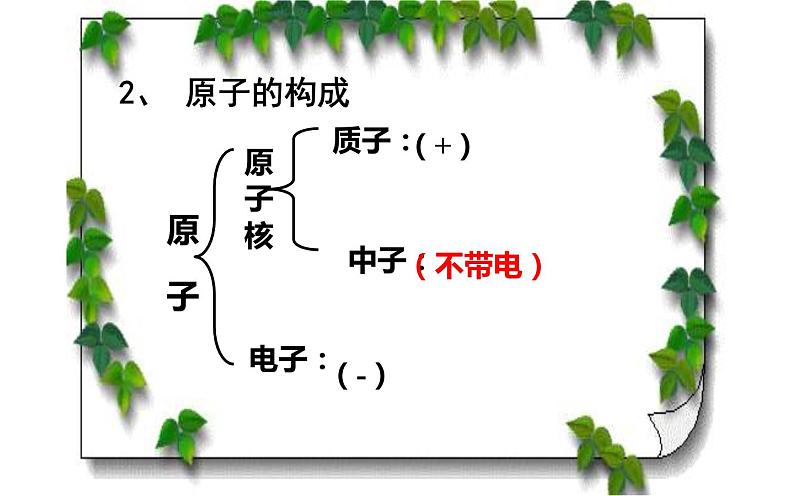
在原子中,由于质子(原子核)与电子所带电荷数相等,但电性相反,所以整个原子不显电性。
即是:核电荷数=质子数=核外电子数
根据原子的结构:1、原子中,质子数=核外电子数=核电荷数;2、质子数不一定等于中子数,原子中 不一定含有中子;3.构成原子的必要粒子是质子和子, 决定原子种类的是核内质子数,它 必不可少。
⑶、相 对 原 子 质 量 的
计 算 公 式:
某原子的相对原子质量 =
一个C12原子的质量 ×
( 数值上 ) 相对原子质量 = 质子数 + 中子数
原子的质量主要集中在原子核上。
电子是在电子层上分层排布的电子层从里到外离核距离由远到近,能量由低到高电子总是尽先排在能量最低的电子层里(即第一层排满了才排第二层,依次下去)每个电子层最多能容纳2n2个电子,最外层不超过8个(如果第一层为最外层不超过2个)
3、 几种元素原子的最外层电子数的特点:
所以 , 决定了元素的化学性质 。
二、离子:带电荷的原子叫做离子
带正电荷的原子叫做阳离子,质子数 核外电子数(”“),形成 结构(稳定或不稳定)。
带负电荷的原子叫做阴离子,质子数 核外电子数(”“),形成 结构(稳定或不稳定)。
在元素符号的右上角标出所带的电荷数,数值在前,符号在后,1可以省略不写。 如:Na+ Mg2+ Cl- O2-
写出下列的离子符号: 铝离子 氟离子 硫离子
Al3+ F- S2-
铝原子 氟原子 硫原子
原子中:质子数=电子数(原子不带电)
阳离子中:质子数>电子数(带正电) 阴离子中:质子数
相关课件
这是一份初中化学人教版 (五四制)八年级全册课题1 分子和原子教学课件ppt,共23页。
这是一份初中化学人教版 (五四制)八年级全册课题1 分子和原子评课课件ppt,共24页。PPT课件主要包含了物质由微观粒子构成,分子可以分为原子,内容提要,学习目标,新知学习,原子结构,分子结构,离子晶体结构,硅表面的原子图像,课堂小结等内容,欢迎下载使用。
这是一份初中化学人教版 (五四制)八年级全册课题1 分子和原子教学课件ppt,共33页。PPT课件主要包含了教学目标,扫描隧道显微镜,分子的模型,水分子自述,观察与思考,同种分子化学性质相同,分子的观点的应用,课堂小结,思考与交流,几种说法等内容,欢迎下载使用。









