




所属成套资源:高中化学新教材选择性必修二课件
人教版 (2019)选择性必修2第一节 原子结构教学演示课件ppt
展开
这是一份人教版 (2019)选择性必修2第一节 原子结构教学演示课件ppt,共12页。PPT课件主要包含了填多少,怎么填,电子对,单电子,原子结构的表示方法等内容,欢迎下载使用。
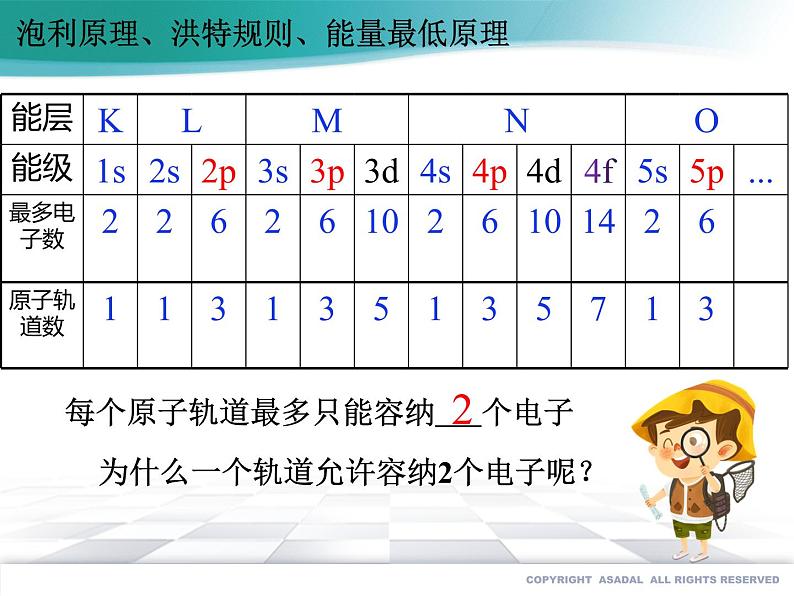
每个原子轨道最多只能容纳 个电子
为什么一个轨道允许容纳2个电子呢?
泡利原理、洪特规则、能量最低原理
电子除空间运动状态外,还有一种状态叫做自旋
电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头(↑和↓)表示自旋相反的电子。
在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反,这个原理被称为泡利原理(也称泡利不相容原理)。
轨道表示式(又称电子排布图)是表述电子排布的一种图式
表示方法:用方框(也可用圆圈)表示原子轨道,能量相同的原子轨道(简并轨道)的方框相连,箭头(↑↓)表示一种自旋状态电子。
如氢和氧的基态原子的轨道表示式为
通常应在方框下方或上方标记能级符号
有时画出的能级上下错落,以表达能量高低不同
基态原子中,填入简并轨道的电子总是先单独分占且自旋平行,称为洪特规则
洪特规则不仅适用于基态原子,也适用于基态离子
洪特规则适用于电子填入简并轨道,并不适用于电子填入能量不同的轨道
1-36号元素基态原子的价层电子的轨道表示式
同一个原子轨道中,自旋方向相反的一对电子
一个原子轨道中只有一个电子,即未成对电子
1-36号元素基态原子中未成对电子为1-6的元素
有少数元素的基态原子的电子排布对于构造原理有1个电子的偏差。因为能量相同的原子轨道在全充满、半充满、 全空状态时,体系的能量较低,原子较稳定。
全充满:p6、d10、f14
半充满:p3、d5、f7
全空:p0、d0、f0
在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低,这就是能量最低原理。
整个原子的能量有 、 和 三个因素共同决定
对电子运动状态描述最详尽
相关课件
这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构集体备课课件ppt,共16页。PPT课件主要包含了目标一泡利原理,电子自旋,s22s22p4,不要标记电子数,练习1,目标二洪特规则,思考与交流1,s22s22p2,s22s22p3,s22s22p5等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构示范课ppt课件,共31页。PPT课件主要包含了s22s22p3,或Ar3d6,①⑤⑥,s23p3,洪特规则,d104s1等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修2第一节 原子结构教案配套ppt课件,共44页。PPT课件主要包含了第一节原子结构等内容,欢迎下载使用。










