
初中化学人教版 (五四制)九年级全册课题2 金属的化学性质教案设计
展开一、教学设计理念
学生己初步具备了一定的观察问题、分析问题和解决问题的能力,对事物的认识正处于从感性到理性的转变时期,实验是激发他们学习兴趣的好方法。因此,在本课题中,我主要让学生利用自己主体意识,对生活中的实际问题加以分析,并从问题中培养学生的思维能力,将学习的主动权交给学生。学生在前一阶段的学习中已经做过镁条、铁丝等在氧气中反应的实验,为加深学生的感性认识,特意让学生结合生活中实际及名言警句,判断铝和金是否与氧气反应,从而得出大多数金属都能与氧气反应,但反应的难易和剧烈程度不同,由此也可在一定意义上反应金属的活泼程度。教材的重点放在对金属活动顺序的探究上,采用实验──讨论的探究模式,通过对实验事实的分析,层层诱导,由学生自己归纳得出金属的化学性质,并通过反应的剧烈程度及反应发生与否,归纳总结出对某些金属活动性的比较,进而引出金属活动性顺序。通过问题的发现及解决,使学生能应用置换反应和金属活动性顺序解释一些与日常生活有关的化学问题,使学生学以致用,“做中学,学中会”。
二、教学目标分析
情感态度与价值观:
(1) 通过对五彩纷呈的化学现象的观察,激发学生的好奇心和求知欲,发展学习化学的兴趣。
(2)培养学生的合作意识以及勤于思考、勇于创新实践、严谨求实的科学精神。
(3)了解化学与日常生活和生产的密切关系,提高学生解决实际问题的能力。
(4)在有趣的实验与老师的点拨中轻松掌握化学知识,体验到学习的快乐。
知识与技能:
(1)知道铁、铝、铜等常见金属与氧气的反应。
(2)初步认识常见金属与盐酸、硫酸的置换反应,以及与盐溶液的置换反应,能用置换反应解释一些与日常生活有关的化学问题。
(3)能用金属活动性顺序对有关的置换反应进行简单地判断,并能利用金属活动性顺序解释一些与日常生活有关的化学问题。
过程与方法:
(1)体验和学习利用控制实验条件进行科学探究的方法,学会运用控制实验条件探究金属活动性顺序。
(2)学习通过对实验现象进行筛选、对比、归纳、分析、进行信息处理,获取科学结论的科学方法。
三、教学重难点:
重点:金属活动性顺序的理解和应用
难点:(1)用置换反应和金属活动性顺序判断反应能否发生。
(2)用置换反应和金属活动性顺序解释某些与生活有关的化学问题。
对实验事实进行筛选、分析、归纳、综合等科学方法的建构。
四、教学方法分析:
实验探究法;多媒体辅助教学法;小组合作交流、讨论、归纳相结合的教学方法。
五、教学准备:
多媒体课件、试管、镊子、酒精灯、坩埚钳、镁条、铝丝、锌粒、铜片、稀盐酸、稀硫酸
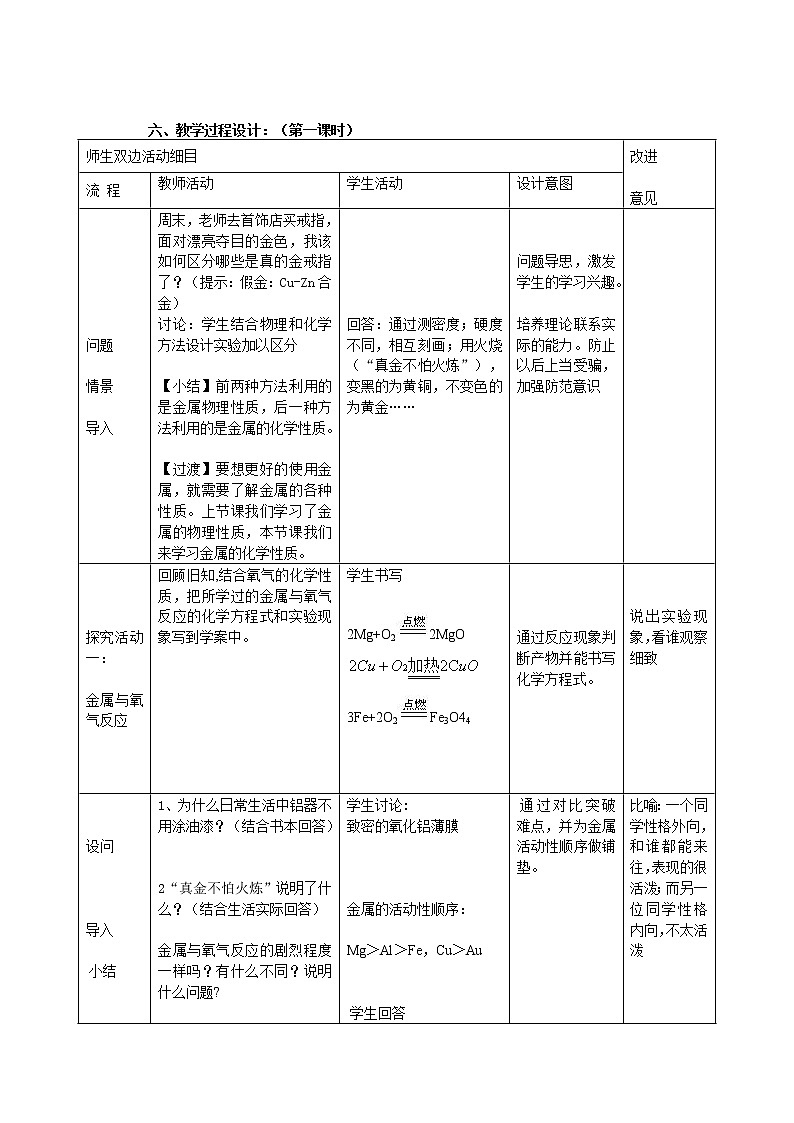
六、教学过程设计:(第一课时)
师生双边活动细目
改进
意见
流 程
教师活动
学生活动
设计意图
问题
情景
导入
周末,老师去首饰店买戒指,面对漂亮夺目的金色,我该如何区分哪些是真的金戒指了?(提示:假金:Cu-Zn合金)
讨论:学生结合物理和化学方法设计实验加以区分
【小结】前两种方法利用的是金属物理性质,后一种方法利用的是金属的化学性质。
【过渡】要想更好的使用金属,就需要了解金属的各种性质。上节课我们学习了金属的物理性质,本节课我们来学习金属的化学性质。
回答:通过测密度;硬度不同,相互刻画;用火烧(“真金不怕火炼”),变黑的为黄铜,不变色的为黄金……
问题导思,激发学生的学习兴趣。
培养理论联系实际的能力。防止以后上当受骗,加强防范意识
探究活动一:
金属与氧气反应
回顾旧知,结合氧气的化学性质,把所学过的金属与氧气反应的化学方程式和实验现象写到学案中。
学生书写
2Mg+O22MgO
3Fe+2O2Fe3O44
通过反应现象判断产物并能书写化学方程式。
说出实验现象,看谁观察细致
设问
导入
小结
1、为什么日常生活中铝器不用涂油漆?(结合书本回答)
2“真金不怕火炼”说明了什么?(结合生活实际回答)
金属与氧气反应的剧烈程度一样吗?有什么不同?说明什么问题?
学生讨论:
致密的氧化铝薄膜
金属的活动性顺序:
Mg>Al>Fe,Cu>Au
学生回答
通过对比突破难点,并为金属活动性顺序做铺垫。
比喻:一个同学性格外向,和谁都能来往,表现的很活泼;而另一位同学性格内向,不太活泼
学生思考
问题导思,激发兴趣,培养理论联系实际、规范表达和综合分析问题的能力。
过渡
【设问】金属与酸反应现象是否也像金属与氧气反应一样存在差别呢?同学们可以先提出自己的假设,设计实验方案,通过实验来探究这个问题。
猜想、假设、设计实验方案。
学生上来书写方案
激发学生兴趣,培养学生思维推理能力和实验设计能力
探究活动三:金属与稀酸的反应
学生分组实验,六人一组,
三组做金属与稀盐酸
反应,两组做金属与稀硫酸反应
【提示】
按操作规范进行实验,认真观察现象。
【巡视、指导实验】
讨论:1.如何控制实验条件?
2.如何应用比较方法?
3.如何收集并记录实验信息?
A组:金属与稀盐酸的反应
金属
是否有气体产生,速度如何
化学方程式
Mg
Zn
Fe
Cu
B组:金属与稀硫酸的反应
金属
是否有气体产生,速度如何
化学方程式
Mg
Zn
Fe
Cu
培养实验操作能力、观察能力、思维推理能力和同学间的合作使学生通过活动,自己发现金属活动性顺序,既有所获,又体验了成功的快感。
获得科学探究方法:控制变量法,对比实验法
知识延伸:为何实验室制取氢气用Zn和稀硫酸,而不用Mg或Cu
强调:铁与稀盐酸或稀硫酸反应,生成物中铁元素为+2价
讨论
小结
【引导学生进行讨论、交流和展示探究结果】
学生进行讨论、交流。展示探究结果:镁、锌、铁、铜的金属活动性由强到弱依次为Mg>Zn>Fe>Cu
在讨论、交流中,吸取别人有益的意见,让不同的意识在碰撞中相互同化。
设问
在镁、锌、铁、铜几种金属中,哪些金属能与盐酸、稀硫酸发生反应?哪些金属不能与盐酸、稀硫酸发生反应?由此你能把金属分为哪两类?哪类金属活泼些?
思考、讨论并得出结论。 结论:可分为能与盐酸、稀硫酸发生反应的金属和不能与盐酸、稀硫酸发生反应的金属这两类。
为后面学习金属活动顺序时,为什么会出现氢元素打下基础。
指导
阅读
欣赏课本图8-13 金属与盐酸反应的比较。
观看动画,对照自己的探究反思:(惊呀,笑):
创设轻松和谐的探究氛围,发展学生想象力,将真实事物以“图景“形式与学生的认知特点协调。
也可以用动漫形式表现,效果更好。
视频回顾实验现象
大家观察视频上的实验操作及现象及时补充书写出对应的反应原理(两个学生上去书写)
请大家从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点?它与我们学过的化合反应和分解反应的特点是否相同?
置换反应:A+BC→AC+B
金属与稀盐酸反应
Mg+2HCl==MgCl2+H2↑
…
…
金属与稀硫酸反应
Zn+H2SO4==ZnSO4+H2↑
Fe+H2SO4==FeSO4+H2↑
…
学生讨论回答:
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应叫做置换反应。
培养学生分析问题能力和实事求是的科学态度。
使学生在交流中互相启发,相互激励,发展和完善自我
探究三
金属与金属化合物溶液反应
新问题引入
过渡】一些金属不能与盐酸或稀硫酸反应,如铜和银,如何确定它们之间活动性顺序呢?
【介绍】“曾青得铁则化为铜”是现代湿法冶金的先驱,也是我国古代劳动人民辛勤智慧的结晶,我们应该加倍努力把我们祖先的业绩发扬光大。
猜想:金属活动性强的能否把活动性弱的从它的化合物溶液中置换出来
提问:如果老师的猜想是正确的,结合对应的实验用品怎样证明Al和Cu的金属活动性强弱(多次实验得出正确结论)
学生回答方案
学生思考
怎样证明Al和Cu的金属活动性强弱
学生回答:将Al与CuSO4溶液反应
学生实验
联系生活,使学生学以致用,能运用置换反应和金属活动性顺序判断反应能否发生,解释某些与生活有关的化学问题。体会“生活处处有化学”。
知识延伸:能否用其他溶液如硝酸银溶液来鉴别?为什么?
为后面学习打下伏笔
用上述得出的方法,想想如何比较Cu与Ag
学生猜测:将Ag与CuSO4放在试管中观察是否反应
结合所给药品做实验
Cu与AgNO3溶液是否反应
课堂总结
金属的化学性质
1、大多数金属能与氧气发生反应,但反应的难易和剧烈程度不同。
2、活泼金属都能和稀盐酸、稀硫酸反应,但反应的难易和剧烈程度不同。
3、排在前面的金属可以和排在后面金属化合物(盐)的溶液反应。
4、金属的活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
布置
作业
1. 设计一个实验证明金属活动性顺序
Zn>Fe>Cu
2. 做课后14页作业1、2、7、8。
板
书
设
计
课题2 金属的化学性质
一、金属的化学性质
1、金属与氧气的反应2Mg+O22MgO 4Al+3O2 2Al2O3
2Cu+O22CuO 3Fe+2O2Fe3O44
金属+氧气→金属氧化物
金属的活动性:
Mg>Al>Fe,Cu>Au
二、金属与酸的反应
Mg+2HCl==MgCl2+H2↑ Zn+H2SO4==ZnSO4+H2↑
Fe+H2SO4==FeSO4+H2↑ Zn+2HCl==ZnCl2+H2↑
Fe+2HCl==FeCl2+H2↑ Mg+H2SO4==MgSO4+H2↑
金属+酸→金属化合物+氢气
金属的活动性:Mg>Zn>Fe>Cu
三、金属与化合物溶液反应
课
后
反
思
新课程标准下的初中化学课堂教学,已经不仅是传授基本知识和技能,更重要的是要通过有效的教学手段,培养学生的科学素养,促进其提高。因此,教师在观念上必须真正转变,找准自己在教学过程中的角色;在教学设计上,要切实以“学生发展”为本,利用一切条件创设情景,让学生主动参与到学习过程中,通过师生互动、生生互动,不断建构和丰富自己的知识。让学生敢于和善于提出自己的见解和新方法,让学生初步掌握了科学探究的方法和思维方法,培养了学生的实验能力、观察能力、实事求是的科学态度以及创新精神。
初中化学人教版 (五四制)九年级全册第一单元 金属和金属材料课题2 金属的化学性质教案: 这是一份初中化学人教版 (五四制)九年级全册第一单元 金属和金属材料课题2 金属的化学性质教案,共4页。教案主要包含了情景导入,温故知新,合作探究,学以致用,课堂小结,作业布置,师生归纳小结等内容,欢迎下载使用。
初中人教版 (五四制)课题2 金属的化学性质教学设计: 这是一份初中人教版 (五四制)课题2 金属的化学性质教学设计,共3页。教案主要包含了活动探究,探究目的,探究方案,观察记录,问题分析等内容,欢迎下载使用。
初中化学人教版 (五四制)九年级全册课题2 金属的化学性质教学设计: 这是一份初中化学人教版 (五四制)九年级全册课题2 金属的化学性质教学设计,共10页。教案主要包含了教学目标,教学重点,教学难点,教学方法,教学准备,教学过程等内容,欢迎下载使用。













