





初中化学人教版 (五四制)九年级全册课题2 金属的化学性质示范课ppt课件
展开这是一份初中化学人教版 (五四制)九年级全册课题2 金属的化学性质示范课ppt课件,共18页。PPT课件主要包含了第一课时,金属与氧气的反应,生活小常识,很快较快较慢不反应,ZnFe,HCl,H2SO4,H2↑+MgSO4,H2↑+ZnSO4,H2↑+FeSO4等内容,欢迎下载使用。
社会上有些不法分子用黄铜(铜锌合金)冒充黄金。因为黄铜从颜色上看,与黄金极为相似,很难区分。同学们能否运用金属的物理性质,区分黄铜(铜锌合金)和黄金?
课题2 金属的化学性质
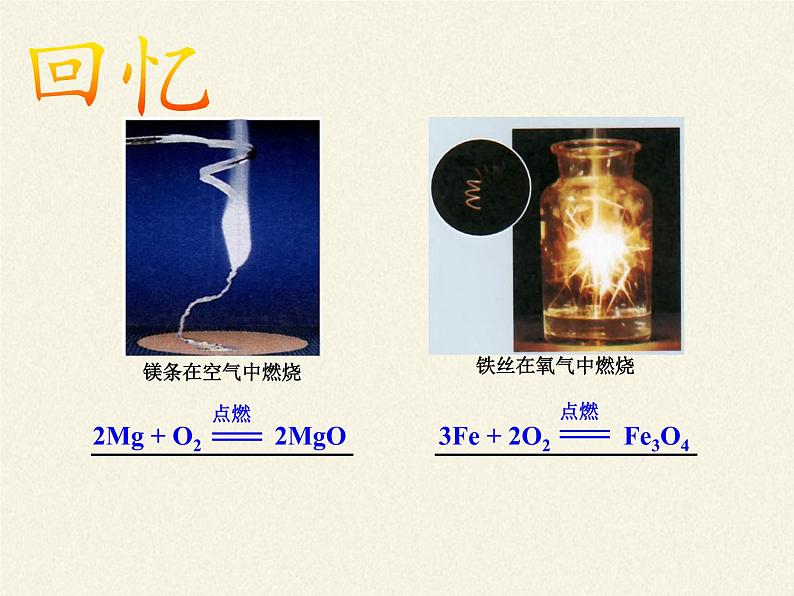
4Al+3O2 =2Al2O3
1、Mg、Al等在常温时就能与氧气反应。
2、Fe、Cu等在高温时才能与氧气反应
3、Au在高温时也不与氧气反应
2Mg+O2 = 2MgO
小结: 活动性较强, 活动性较弱, 活动性最弱。
用铁锅烧菜时可在锅中加入少量食醋,醋酸能与铁反应生成人体易吸收的亚铁盐,从而起到补铁的作用。
二、金属与盐酸、稀硫酸的反应
金属与酸反应的剧烈程度,也能反映出金属活动性的强弱。
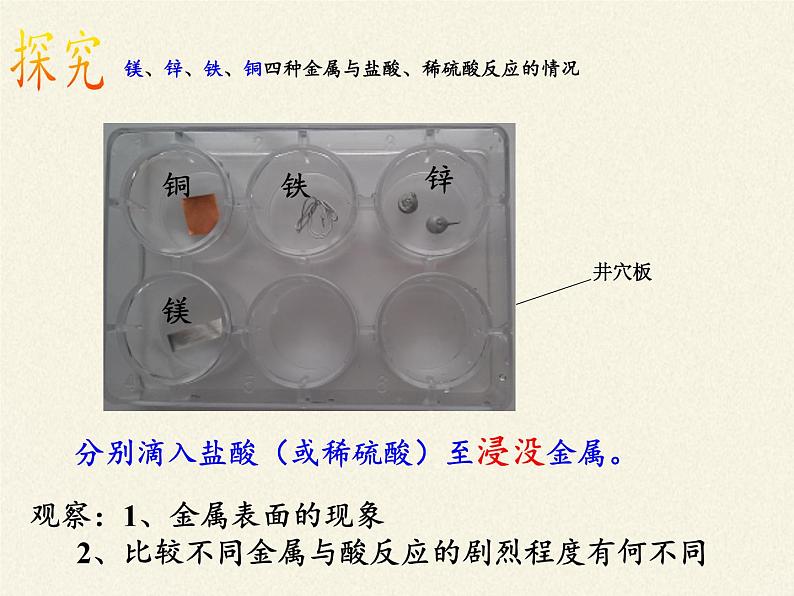
镁、锌、铁、铜四种金属与盐酸、稀硫酸反应的情况
分别滴入盐酸(或稀硫酸)至浸没金属。
观察:1、金属表面的现象 2、比较不同金属与酸反应的剧烈程度有何不同
观察:1、金属表面的现象2、比较不同金属与酸反应的剧烈程度有何不同
有气泡产生有气泡产生有气泡产生没有气泡
根据实验现象回答:1、哪些金属能与盐酸、稀硫酸发生反应? 反应剧烈程度如何?2、哪些金属不能与盐酸、稀硫酸发生反应?
判断金属活动性的方法之二:
可根据金属与盐酸或稀硫酸 反应及反应的 程度来判断金属活动性的强弱。
谁强谁弱你看清楚了吗?
小结:金属活动性顺序:___﹥___﹥ ___﹥ ___
很快 较快 较慢 不反应
金属与酸(盐酸、稀硫酸)反应产生的气体?
H2↑ + MgCl2
H2↑ + ZnCl2
H2↑ + FeCl2
Mg + H2SO4 = H2 ↑ + MgSO4
Mg + 2HCl = H2 ↑ + MgCl2
Zn + H2SO4 = H2 ↑ + ZnSO4
Zn + 2HCl = H2 ↑ + ZnCl2
Fe + H2SO4 = H2 ↑ + FeSO4
Fe + 2HCl = H2 ↑ + FeCl2
讨论:下列化学方程式有何共同特征?
置换反应是化学反应的基本类型之一
一. 金属与氧气的反应
二.金属与盐酸、稀硫酸反应 ( 置换反应 )
Mg + 2HCl == MgCl2 + H2 ↑Mg + H2 SO4 == Mg SO4 + H2 ↑Zn + 2HCl == ZnCl2 + H2 ↑ Zn + H2 SO4 == Zn SO4 + H2 ↑Fe + 2HCl == FeCl2 + H2 ↑Fe + H2 SO4 == Fe SO4 + H2 ↑
置换反应:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应
请同学们运用已掌握的化学知识,设计实验方案,来鉴别黄铜(铜锌合金)和黄金。
相关课件
这是一份人教版 (五四制)九年级全册第一单元 金属和金属材料课题2 金属的化学性质评课ppt课件,共26页。PPT课件主要包含了科普小知识,第1课时,学习目标,探究新知,MgAl,FeCu,我能判断,学以致用等内容,欢迎下载使用。
这是一份初中化学人教版 (五四制)九年级全册课题2 金属的化学性质评课ppt课件,共28页。PPT课件主要包含了金属与氧气反应,不反应,>锌Zn,>铁Fe,>铜Cu,镁Mg,镁比锌活泼,锌比铁活泼,铁比铜活泼,置换反应等内容,欢迎下载使用。
这是一份人教版 (五四制)九年级全册课题2 金属的化学性质课文课件ppt,













