



鲁教版 (五四制)九年级全册第二单元 常见的酸和碱4 酸碱中和反应课文内容ppt课件
展开1.掌握中和反应的定义,理解酸和碱发生中和反应的本质;2.了解中和反应过程中溶液pH的变化;3.了解中和反应在实际生活中的应用。
农业和工业上常用熟石灰来改良酸性土壤和处理酸性废水,你知道其中的原理吗?
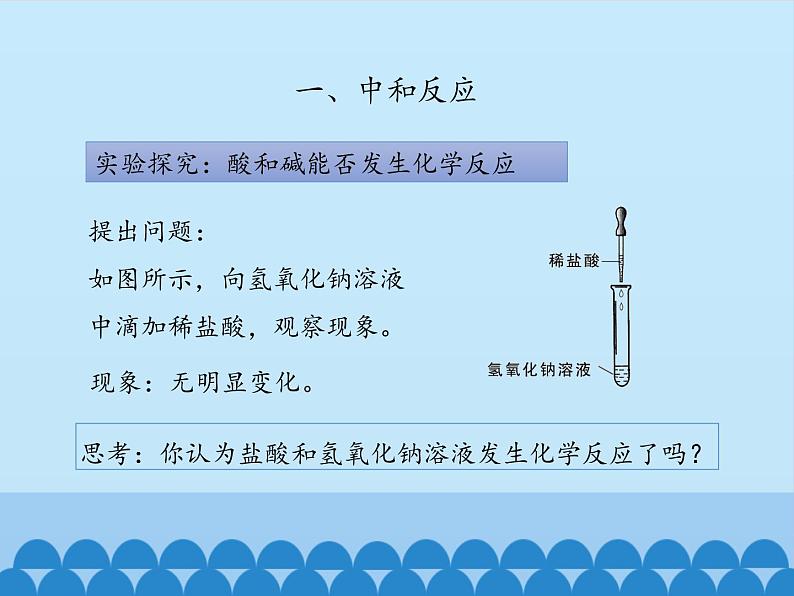
实验探究:酸和碱能否发生化学反应
提出问题:如图所示,向氢氧化钠溶液中滴加稀盐酸,观察现象。
思考:你认为盐酸和氢氧化钠溶液发生化学反应了吗?
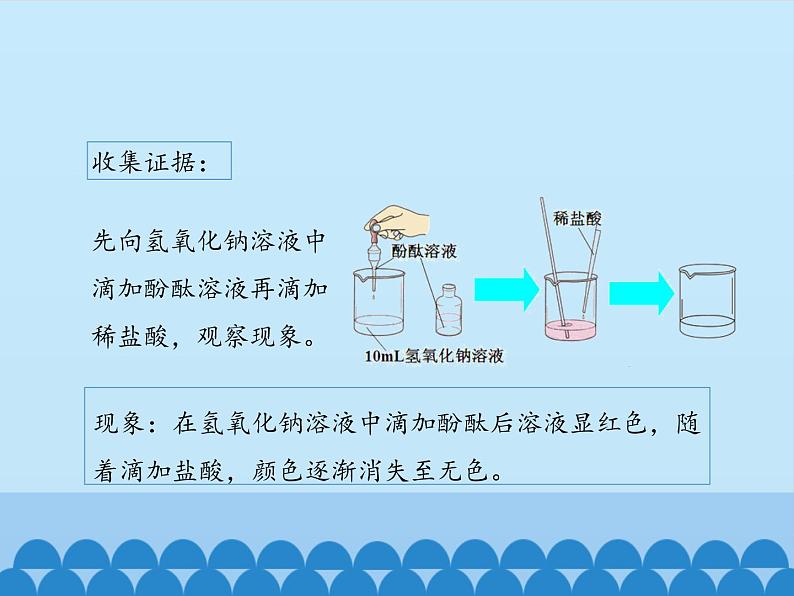
现象:在氢氧化钠溶液中滴加酚酞后溶液显红色,随着滴加盐酸,颜色逐渐消失至无色。
先向氢氧化钠溶液中滴加酚酞溶液再滴加稀盐酸,观察现象。
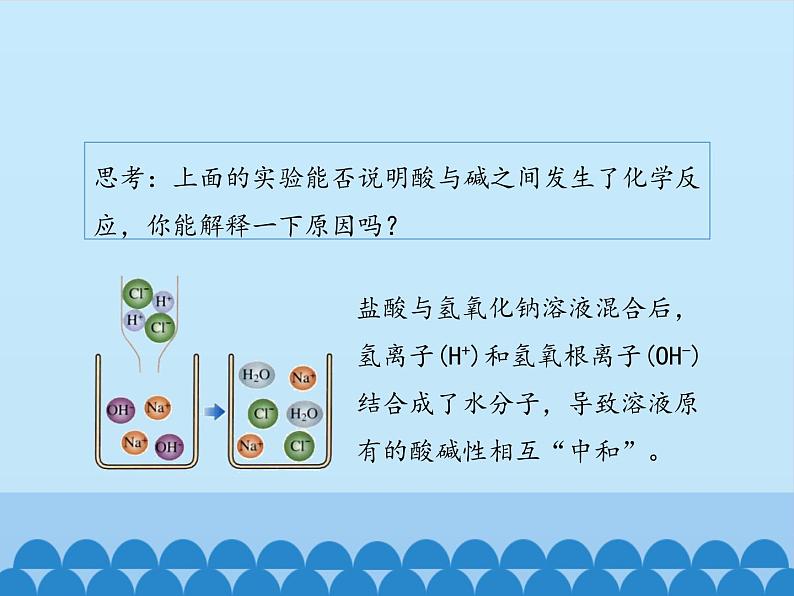
思考:上面的实验能否说明酸与碱之间发生了化学反应,你能解释一下原因吗?
盐酸与氢氧化钠溶液混合后,氢离子(H+)和氢氧根离子(OH-)结合成了水分子,导致溶液原有的酸碱性相互“中和”。
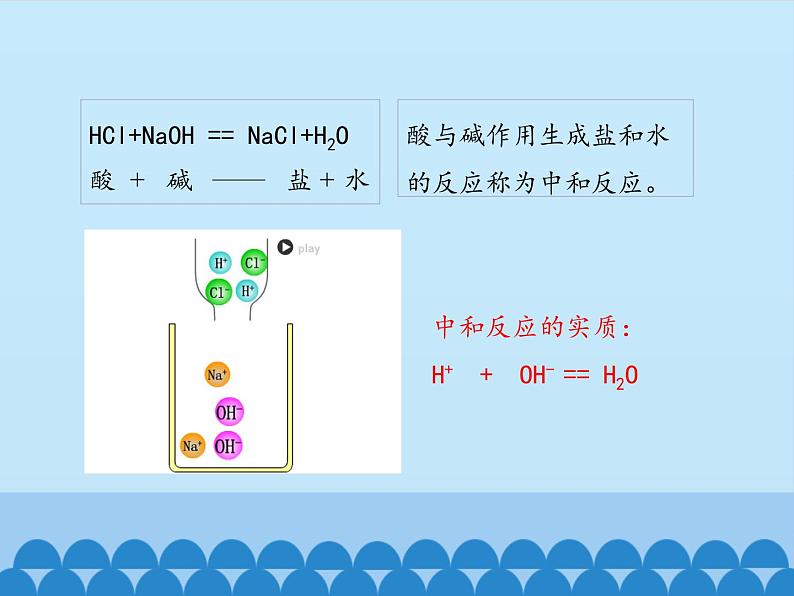
HCl+NaOH == NaCl+H2O酸 + 碱 —— 盐 + 水
酸与碱作用生成盐和水的反应称为中和反应。
中和反应的实质: H+ + OH- == H2O
HCl + KOH == KCl + H2O
2HCl + Ba(OH)2== BaCl2 + 2H2O
H2SO4 + 2KOH == K2SO4 + 2H2O
H2SO4 + Ba(OH)2 == BaSO4↓ + 2H2O
活动天地:酸碱中和反应过程中溶液pH的变化
向定量的盐酸溶液中逐滴加入氢氧化钠溶液,测定此过程中溶液pH的变化。
0 2 4 6 8 10 12 14 16 18 V/m L
12 11 10 9 8 7 6 5 4 3 2 1
当滴加的氢氧化钠量较少时,溶液中盐酸有剩余,溶液呈酸性,pH<7;
当滴加的氢氧化钠量恰好与溶液中盐酸完全反应时,溶液呈中性,pH=7;
当滴加的氢氧化钠过量时,溶液中氢氧化钠有剩余,溶液呈碱性,pH>7。
中和蚊虫叮咬时“注射”的甲酸可以用肥皂水、小苏打水、稀氨水或清凉油。
中和反应的应用——1.用于医药卫生
胃酸过多导致胃部不适或疼痛时可口服碱性药物,以降低胃酸的含量。如“胃舒平”(主要成分为Al(OH)3)或小苏打片(主要成分是NaHCO3)
利用中和反应原理,向土壤中加入酸性或碱性物质,将土壤pH控制在最适宜农作物生长的范围之内。如撒熟石灰中和酸性土壤。
酸性或碱性废水必须先进行处理,达标后才可以排放,否则会造成水体污染。
思考:化学实验产生的酸性或碱性废液能否直接倒入下水道中?应如何处理?
科学实验需将溶液的pH控制在一定范围内。若溶液酸碱性太强或太弱,都可用适当的碱或酸调节溶液pH。
知识点1:中和反应向滴有酚酞试液的氢氧化钠溶液中逐滴滴入稀硫酸至过量,下面的叙述中正确的是( ) A.溶液由红色变为无色,pH逐渐增大 B.溶液由无色变为红色,pH逐渐减小 C.溶液由红色变为无色,pH逐渐减小 D.溶液颜色不变,pH逐渐增大
知识点2:中和反应的应用食用松花蛋时常感到有涩味,这是因为制作松花蛋的过程中用到了熟石灰和纯碱等原料。为了减轻涩味,可在食用松花蛋时添加某种调味品,这种调味品最好是( ) A、食盐 B、食醋 C、香油 D、味精
1. X可以发生如下反应:①X+酸→盐+水;②X+非金属氧化物→盐+水。X可能是( )A.氧化铜 B.盐酸C.氢氧化钠 D.碳酸钠
2.下列实际应用中,利用中和反应原理的是( )①用氢氧化钠溶液洗去石油产品中的残余硫酸;②用稀硫酸除铁锈;③用熟石灰改良酸性土壤;④用碳酸氢钠治疗胃酸过多。A.①③ B.③④ C.①②④ D.①③④
3.下列化学反应发生后,将使用过的仪器浸泡于稀盐酸中,然后用水冲洗,不能将仪器处理干净的是( )A.盛放石灰水的试剂瓶 B.用一氧化碳还原氧化铁后的硬质玻璃管 C.氢气还原氧化铜后,敞口放置一段时间附有红色固体残渣的试管 D.盛放过生锈铁钉后留下红棕色固体的烧杯
鲁教版 (五四制)九年级全册4 酸碱中和反应图文课件ppt: 这是一份鲁教版 (五四制)九年级全册4 酸碱中和反应图文课件ppt,共36页。PPT课件主要包含了学习目标,探究一,中和反应,应用于医药卫生等内容,欢迎下载使用。
初中化学鲁教版 (五四制)九年级全册第二单元 常见的酸和碱4 酸碱中和反应说课课件ppt: 这是一份初中化学鲁教版 (五四制)九年级全册第二单元 常见的酸和碱4 酸碱中和反应说课课件ppt,共36页。PPT课件主要包含了学习目标,探究一,中和反应,应用于医药卫生等内容,欢迎下载使用。
初中化学4 酸碱中和反应图片ppt课件: 这是一份初中化学4 酸碱中和反应图片ppt课件,共23页。PPT课件主要包含了溶液由红色变为无色,酸和碱能反应,微观世界,中和反应,或铵根离子,NH4NO3,NaOH,硫酸铜,H2SO4,Fe2O3等内容,欢迎下载使用。













