






人教版 (2019)必修 第一册第三节 化学键获奖ppt课件
展开
这是一份人教版 (2019)必修 第一册第三节 化学键获奖ppt课件,共35页。PPT课件主要包含了核心素养,教学目标,Cl-,电子转移,离子键,电子式,直接用离子符号,简单阳离子,简单阴离子,1原子的电子式等内容,欢迎下载使用。
到目前为止,已经发现的元素只有一百多种,而这些元素组成的物质却有数千万种,那么为数不多的元素的原子是通过什么作用形成种类繁多的物质的呢?
宏观辨识与微观探析:通过微观角度分析物质的形成,进而理解宏观的化学反应是微观的离子之间的重新组合,理解化学反应的微观本质,帮助学生初步形成透过现象看本质的唯物主义观点。证据推理与模型认知:建立离子化合物和共价化合物的基本概念,理解化学反应的微观本质模型是旧化学键的断裂和新化学键的形成,树立根据该模型进行化学反应过程推理的科学思想。科学精神与社会责任:裂解化学键理论在化学研究中的具体应用,培养学生的科学精神,理解化学在社会发展中的重要作用。
1.理解离子键的概念,能用电子式表示离子化合物的形成过程。2.通过典型实例认识化学键的概念和化学反应的本质。3.理解共价键和共价化合物的概念。4.用电子式表示简单共价化合物的形成过程。5.了解化学键、氢键的概念。
1.化学键、离子键、共价键的概念。2.电子式的书写。
1.电子式的书写。2.离子化合物、共价化合物的判断。
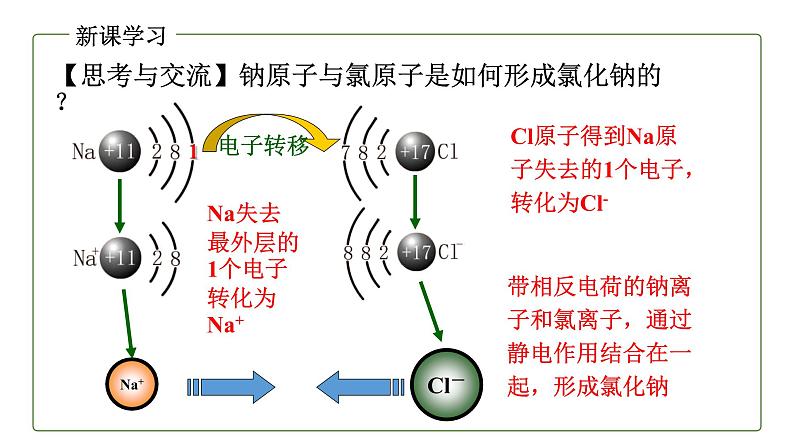
【思考与交流】钠原子与氯原子是如何形成氯化钠的?
Cl原子得到Na原子失去的1个电子,转化为Cl-
Na失去最外层的1个电子转化为Na+
带相反电荷的钠离子和氯离子,通过静电作用结合在一起,形成氯化钠
1. 概念:带相反电荷离子之间的强烈相互作用
2. 成键粒子:阴阳离子
3. 成键本质:静电作用
4. 原子形成离子键
5. 离子键成键的原因是原子间相互 电子达到 结构;体系的总能量 。
6. 离子化合物(1)离子化合物的概念是 。(2)请举例说明常见的离子化合物的类型:___________________________ 。
活泼金属氧化物(如Na2O、MgO等);
绝大多数盐(如NaCl、K2SO4、CaCO3等);强碱[如NaOH、Ba(OH)2等]
在元素符号周围用小黑点 · (或×)来表示原子的最外层电子的式子
(2)简单离子的电子式
②相同离子不能合并, 同性电荷不直接相邻
①由阴、阳离子的电子式组成
(4)用电子式表示由原子形成离子化合物的过程
④右侧写离子化合物的电子式
②用弧形箭头表示电子转移的方向
为什么2个氢原子结合成氢分子,2个氯原子结合成氯分子,而不是3个、4个呢?为什么1个氢原子和1个氯原子结合成氯化氢分子,而不是以其他的个数比相结合呢?
H2 + Cl2 = 2HCl
在HCl分子的形成过程中,没有发生电子的得失,而是通过共用电子对双方达到稳定结构
1. 定义:原子之间通过共用电子对所形成的强烈相互作用
2. 共价键的成键特点
3. 共价化合物:不同原子之间以共用电子对形成分子的化合物。
(2) 多原子非金属单质
(3) 含根的离子化合物
含有共价键的化合物不一定是共价化合物
NaOH 、 Na2O2 、 NH4Cl 、NH4NO3
Cl2、 O3、 P4
HCl、 CO2 、NH3
非极性键:共用电子对不发生偏移
极性键:共用电子对偏向某一方
①每个原子一般达到相对稳定结构
②不加中括号[ ],不标正负电荷数
③原子周围共用电子对数=8-原子最外层电子数
6. 分子的电子式和结构式
(2)结构式
分别用“-、═、≡”表示一对、二对和三对共用电子对
【表4-6】共价键形成的分子及其结构模型
7. 用电子式表示原子形成共价键
(1) 定义:使离子或原子相结合的强烈相互作用
(3) 化学反应的实质:旧化学键断裂和新化学键形成的过程
AgNO3 +NaCl = AgCl ↓ + NaNO3
2. 离子键和共价键的比较
3. 离子化合物与共价化合物的比较
离子键或离子键与共价键
较化学键弱得多,较分子间作用力稍强
分子间(HF、H2O、NH3)
某些具有强极性键的氢化物分子间的相互作用(静电作用)
物质分子间存在微弱的相互作用
相邻的两个或多个原子间强烈的相互作用
4. 化学键、分子间作用力、氢键的比较
分子间氢键的存在使物质的熔、沸点升高,在水溶液中溶解度增大,如熔、沸点:H2O>H2S,HF> HCl,NH3>PH3
①影响物质的熔点、沸点、溶解度等物理性质;②组成和结构相似的物质,随着相对分子质量的增大,物质的熔、沸点逐渐升高。
①离子键:离子键越强,离子化合物的熔、沸点越高;②共价键:共价键越强,单质或化合物的稳定性越大
主要影响物质的熔点、沸点、密度
主要影响物质的物理性质,如熔、沸点
主要影响物质的化学性质
1.下列说法正确的是( )A.离子键就是使阴、阳离子结合成化合物的静电引力B.所有金属与所有非金属原子之间都能形成离子键C.因为离子键是一种强相互作用,所以离子化合物均很难分解D.含有离子键的化合物一定是离子化合物
2.H2O2中不存在的化学键类型是( )A.极性键 B.非极性键C.离子键 D.共价键
3.下列变化过程中,无化学键断裂或生成的是( )A.石墨转化为金刚石 B.KCl晶体溶于水C.蔗糖熔化 D.H2SO4溶于水
1.D【解析】离子键是使阴、阳离子结合成化合物的静电作用,要注意静电作用包含静电引力和静电斥力,A项错误;活泼金属与活泼非金属原子直接化合才能形成离子键,B项错误;NH4Cl为离子化合物,但较易分解,C项错误;含有离子键的化合物一定是离子化合物,D项正确。2.C【解析】形成离子键时,成键微粒中要么含有金属离子,要么含有NH4+,故H2O2中不存在离子键。H2O2的电子式为 ,氧原子之间形成的是非极性键,氢原子与氧原子之间形成的是极性键,C错误。3.C【解析】石墨转化为金刚石是化学变化,化学变化一定有化学键断裂和生成;KCl是离子化合物,晶体溶于水时离子键破坏;蔗糖熔化时破坏的是分子间作用力;H2SO4是共价化合物,且是电解质,溶于水时破坏共价键,故选C。
4.3 化学键一、离子键 1.离子键 2.离子化合物二、共价键1.共价键 2.共价化合物三、化学键1.化学键 2.离子键和共价键的比较3.离子化合物与共价化合物的比较
相关课件
这是一份人教版 (2019)第三节 化学键图文ppt课件,共33页。
这是一份人教版 (2019)必修 第一册第三节 化学键示范课课件ppt,共32页。PPT课件主要包含了导入新课,静电作用,细口瓶,带相反电荷离子,阳离子和阴离子,活泼金属,活泼非金属,离子键,归纳总结,最外层等内容,欢迎下载使用。
这是一份高中人教版 (2019)第四章 物质结构 元素周期律第三节 化学键教课ppt课件,共34页。PPT课件主要包含了Cl-等内容,欢迎下载使用。










