


化学九年级上册第三单元 物质构成的奥秘课题2 原子的结构备课ppt课件
展开构成原子的粒子原子中各粒子之间的关系及带电情况相对原子质量
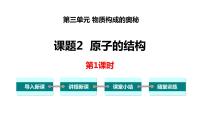
1911年,卢瑟福用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔,发现:①大多数α粒子能穿透金箔而不改变原来的运动方向;②一小部分α粒子改变了原来的运动方向;③有极少数α粒子被弹了回来。
你想知道出现这种现象的原因吗?
【阅读材料】《漫游原子世界》我是一个小小的电子,我在原子里围绕着原子核不停地转动,虽然空间很大,但我和我的同伴总想挣脱原子核的吸引。可是原子核这小老头很有能耐,虽然只占原子的一丁点空间,里面却由质子和中子构成,中子不带电,质子带正电,正好把我身上的负电深深吸引。
原子的结构(播放视频)
道尔顿“原子论”模型简介 (播放视频)
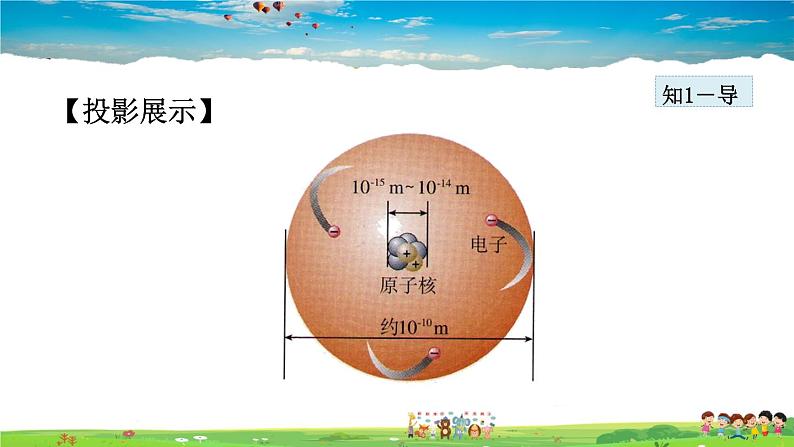
结论:(1)原子不是一个实心球体;(2)原子是由居于原子中心的原子核和核外电子构成的;(3)原子核带正电荷,电子带负电荷。
每个质子带一个单位的正电荷
每个电子带一个单位的负电荷
【例1】[中考·广州]原子的构成示意图如图所示,下列叙述正确的是( )A.原子是实心球体B.质子与电子质量相等C. 质子、中子、电子均匀地分布在原子中D.整个原子的质量主要集中在原子核上
导引:学会看图识原子:一看原子结构——由原子核和核外电子构成,二看数字——原子核的直径数量级是原子直径数量级的10-5~10-4,原子核的体积很小,原子不是实心球体。
关于原子结构,要注意以下几点:1.原子一般由质子、中子、 电子构成,但不是所有 的原子中都含有中子, 如普通氢原子中不含有中子。 2.原子可以再分,原子是化学变化中的最小粒子,在化学变化中不能再分。
【中考•荆州】原子核中一定含有的粒子是( )A.中子 B.质子 C.电子 D.质子和中子
知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c对应的分别是( )
A.原子、原子核、核外电子 B.原子核、原子、核外电子C.原子、核外电子、原子核 D.核外电子、原子核、原子
下列关于原子的叙述错误的是( )A.原子不显电性B.原子是实心球体C.原子由原子核和核外电子构成D.原子可以构成分子
【中考•常州】道尔顿、汤姆生和卢瑟福等科学家对原子结构进行了不断探索。下列叙述正确的是( )①原子由原子核和核外电子构成②原子的质量主要集中在原子核上③原子核在原子中所占的体积极小A.①② B.①③ C.②③ D.①②③
原子中各粒子之间的关系及带电情况
由于原子里质子数等于电子数,一个质子和一个电子所带的电量相等,电性相反,所以整个原子不显电性。
相对于原子,原子核体积很小。
原子构成的规律:(1)核电荷数 = 质子数 = 核外电子数(原子核所带的电荷数简称为核电荷数)(2)原子中不一定含有中子。(3)不同种类的原子,质子数和电子数都不相同。
【例2】[中考·漳州]紫薯中含有被誉为“抗癌大王”的硒元素。已知硒原子的核电荷数为34,中子数为44,则硒原子的核外电子数为( )A.10 D.78
导引:原子中质子、中子、电子间的数量关系可运用推理法得出结论。原子由带正电荷的原子核与核外带负电荷的电子构成,原子不显电性,因此,原子核所带正电荷数与核外电子所带负电荷数相等,中子不带电,所以质子数、核电荷数与核外电子数均相等。
化学学习是一个不断积累、完善的过程,在学习过程中要注意:1.及时总结、回顾和反思。如在上一课题中我们学习了原子是化学变化中的最小粒子,为什么要强调“化学变化”这一关键词呢?今天学习了原子的构成,大家就恍然大悟了。
2.掌握规律中的一般与特殊情况,如原子由质子、中子、电子构成,这是一般规律,但普通氢原子中不含中子,又是特例。 掌握了一般规律,学习时可以举一反三,了解了一般规律中的特殊个例,对相关内容就有了全面的认识。
3.1999年度诺贝尔化学奖获得者艾哈迈德·泽维尔开创了化学研究的新领域,他使运用激光光谱技术观察化学反应时分子中原子的运动成为可能。
【中考•来宾】下列各种粒子,带负电荷的是( )A.电子 B.中子 C.质子 D.原子核
【中考•重庆】同一原子中,下列说法错误的是( )A.质子和电子的数目相同B.原子和中子的电性不同C.原子核和电子的质量不同D.原子核和原子的体积不同
(1)不同原子的质量不同;(2)原子的质量很小;(3)如此小的数据书写、使用均不方便。
(3)相对原子质量与质子数和中子数的关系:
相对原子质量=质子数+中子数
【例3】下列关于相对原子质量的说法正确的是( )A.相对原子质量就是原子的实际质量B.相对原子质量是原子质量与一种碳原子质量的比值C.原子质量越大,相对原子质量就越大D.相对原子质量的单位为“g”
【例4】美国科学家劳伦斯·利费莫尔宣布他与俄罗斯科学家成功合成了一种核外电子数为118、中子数为179的超重元素原子,该原子的相对原子质量和质子数分别是( )A. 297、118 B. 118、297 C. 118、179 D. 179、118
导引:根据原子中粒子间的数量关系解题,即:在原子中,质子数等于核外电子数,相对原子质量近似等于质子数与中子数之和。
原子中存在的数量关系:1.质子数=核电荷数=核外电子数。2.相对原子质量≈质子数+中子数。 原子中数字的作用:根据质子数可以画出原子的结构示意图,根据结构示意图中最外层电子数,可初步确定原子的种类、化学性质等。
【中考•温州】5月9日,相关机构发布 等四种元素的中文名称, 元素的核电荷数为118,相对原子质量为294,则原子核外电子数为( )A.118 B.176 C.294 D.412
某原子核内质子数为19,中子数比核外电子数多1,则该原子中所含微粒(质子、中子、电子)总数为( )A.39 B.59 C.58 D.40
【中考•巴彦淖尔】2015年10月,中国科研团队首次证实了天然铀单质的存在。用于核电工业的一种铀原子中含有92个质子和143个中子,有关该原子的说法不正确的是( )A.属于金属原子 B.原子序数为92C.核外电子数为92 D.相对原子质量为143
甲原子与乙原子的质量比为a∶b,而乙原子与碳12原子的质量比为c∶d,则甲的相对原子质量为( )
已知一个碳12原子的质量为1.993×10-26 kg,则相对原子质量为24的镁原子的质量为____________kg,一个质量为2.325×10-26 kg的某原子相对原子质量约为________。
3.986×10-26
核电荷数=质子数=核外电子数
二、相对原子质量定义式:
某原子的相对原子质量Ar
下列有关原子构成的叙述中,正确的是( )A.原子都是由质子、中子和电子构成的B.原子核内质子数等于中子数C.原子中质子数一定等于电子数D.原子不显电性是因为构成原子的粒子都不带电
:不是所有原子都是由质子、中子和电子构成的,如普通氢原子中没有中子,故A错;原子中质子数等于核外电子数,与中子数不一定相等,故B错,C对;原子不显电性不是因为构成原子的粒子都不带电,而是原子核内质子所带的电荷与核外电子所带的电荷数量相等,电性相反。
下列说法中正确的是( )A.原子的质量主要集中在原子核上B.相对原子质量就是原子的实际质量C.相对原子质量近似等于质子数和电子数之和D.相对原子质量是一个比值,没有单位
:电子的质量比质子、中子的质量小得多,可以忽略不计,所以原子的质量主要集中在原子核上,故A正确;相对原子质量不是原子的实际质量,它是以一种碳原子质量的1/12为标准,其他原子的质量与它相比所得的比值,作为这种原子的相对原子质量,故B错;
相对原子质量的单位是“1”,而不是“g”或“kg”,故D错;由于原子的质量主要集中在原子核上,而原子核中每一个质子和中子的质量都约等于一个碳12原子质量的1/12,故相对原子质量约等于质子数与中子数之和,故C错。
1.填空题(1) 构成物质的粒子有_________、_________和_________等。例如,氢气的构成粒子是________,汞的构成粒子是________,氯化钠的构成粒子是________和________。
2.选择题(1)原子核( )。A.由电子和质子构成B.由质子和中子构成C.由电子和中子构成D.由质子、中子和电子构成
(2)在原子里质子数等于( )。A.中子数B.电子数C.中子数和电子数之和D.中子数和电子数之差(3)碳的相对原子质量是( )。A. 12gB. 12C. 1.66 ×10-27kgD. 1/12 g
3.以氧原子为例回答问题:构成原子的粒子有哪几种?它们是怎样构成原子的?为什么整个原子不显电性?
构成原子的粒子有质子、中子、电子;
在氧原子中8个质子和8个中子构成原子核,8个电子绕着原子核高速运动,这样就构成了氧原子;每个质子带1个单位正电荷,中子不带电,每个电子带1个单位负电荷,原子中核电荷数=质子数=核外电子数;由于原子核内质子所带电荷与核外电子的电荷数量相等,电性相反,所以整个原子不显电性。
4.从附录Ⅱ中查出氮、硫、氯、钙的相对原子质量(保留小数点后一位)。
氮:14.0;硫:32.1;氯:35.5;钙:40.1
5.从附录Ⅱ中查出钠、镁、铝的相对原子质量。根据所查数据,比较相同质量的钠、镁、铝三种金属,哪一种所含的原子最多?哪一种所含的原子最少?为什么?
相对原子质量:钠:22.99,镁:24.31,铝:26.98。相同质量的三种金属,所含原子数钠最多,铝最少;因钠的相对原子质量最小,铝的相对原子质量最大。金属是由原子直接构成的,金属质量=单个原子质量×原子个数,相对原子质量=一个原子质量碳12原子质量× 1/12 ,
所以单个原子质量=相对原子质量×(碳12原子质量× 1/12),金属质量=相对原子质量×原子个数×(碳12原子质量× 1/12)。由此可知,金属质量相等,相对原子质量越大,所含原子个数越少;相对原子质量越小,所含原子个数越多。钠的近似相对原子质量为23,镁为24,铝为27,所以所含原子数钠最多,铝最少。
6.碳12原子的质量为1.993×10-26kg,一种铁原子的质量为9.288×10-26kg,计算该铁原子的相对原子质量(保留小数点后一位)。
人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构精品作业ppt课件: 这是一份人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构精品作业ppt课件,文件包含课件pptx、教案docx、作业doc、学案docx等4份课件配套教学资源,其中PPT共32页, 欢迎下载使用。
化学第三单元 物质构成的奥秘课题2 原子的结构示范课课件ppt: 这是一份化学第三单元 物质构成的奥秘课题2 原子的结构示范课课件ppt,共32页。PPT课件主要包含了微粒构成物质,金箔-黄金锤成的薄片,原子还能再分吗,请说出你的猜想,请说出你的证据,原子不能再分的证据,原子能再分的证据,电子的发现,建立模型,科学实验等内容,欢迎下载使用。
人教版九年级上册课题2 原子的结构说课课件ppt: 这是一份人教版九年级上册课题2 原子的结构说课课件ppt,共19页。PPT课件主要包含了一个单位正电荷,一个单位负电荷,难得失,易失去,不稳定,易得到,ABD,原子中子,改变了原来的,运动方向等内容,欢迎下载使用。