

2019年四川省眉山高三一模化学试卷及答案
展开1.(6分)当前,汽车尾气已成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下
下列关于该“消除”过程的叙述不正确的是( )
A.部分光能转变为化学能
B.消除总变化为NO2+O2+H2O→HNO3
C.消除反应能全天候发生
D.使用纳米TiO2的消除效率更高
2.(6分)NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.在6.0gSiO2晶体中,含有的Si﹣O键数目为0.2NA
B.完全燃烧乙酸、葡萄糖混合物6.0g,消耗的O2数目为0.2NA
C.在常温下,1m3pH=4的溶液中由水电离出的H+数目为0.1NA
D.2.24LCl2完全与CH4发生取代反应,生成的HCl数目为0.1NA
3.(6分)科学家发现半胱氨酸能增强艾滋病毒感染者的免疫力,对控制艾滋病毒的蔓延有奇效。已知半胱氨酸的结构简式为,下列关于半胱氨酸说法不正确的是( )
A.能溶于水、乙醇等溶剂
B.既能与盐酸、又能与NaOH溶液反应
C.与(高半胱氨酸)互为同系物
D.官能团不变的同分异构体有2种
4.(6分)下列实验方案能达到相应实验目的是( )
A.AB.BC.CD.D
5.(6分)中科院深圳先进技术研究院成功研发了一种高效低成本储能电池﹣﹣“铝一石墨”双离子充电电池,电池总反应为Al+xC+Li++PF6ˉAlLi+CxPF6.下列有关该电池的说法正确的是( )
A.放电时,PF6﹣向正极移动
B.放电时,负极反应为Al﹣3e﹣=Al3+
C.充电时,两个电极增加的质量相等
D.充电时,阳极反应为xC+PF6﹣﹣e﹣═CxPF6
6.(6分)草酸(H2C2O4)是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液里lgX[X表示 或]随pH的变化关系如图所示。下列说法不正确的是( )
A.直线I中X表示的是
B.直线I、II的斜率均为1
C.c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)对应1.22<pH<4.19
D.c(Na+)=c(HC2O4﹣)+2c(C2O42﹣)对应pH=7
7.(6分)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,它们可以组成化学式为ZXY3W8的硅酸盐。X3+与W2﹣具有相同的电子层结构,W、Z与X、Y的质子数之和相等。下列判断正确的是( )
A.简单离子半径:X>Z
B.简单气态氢化物稳定性:Y>W
C.最高价氧化物对应水化物酸性:X>Y
D.化合物ZXW2的水溶液呈碱性
二、解答题(共3小题,满分0分)
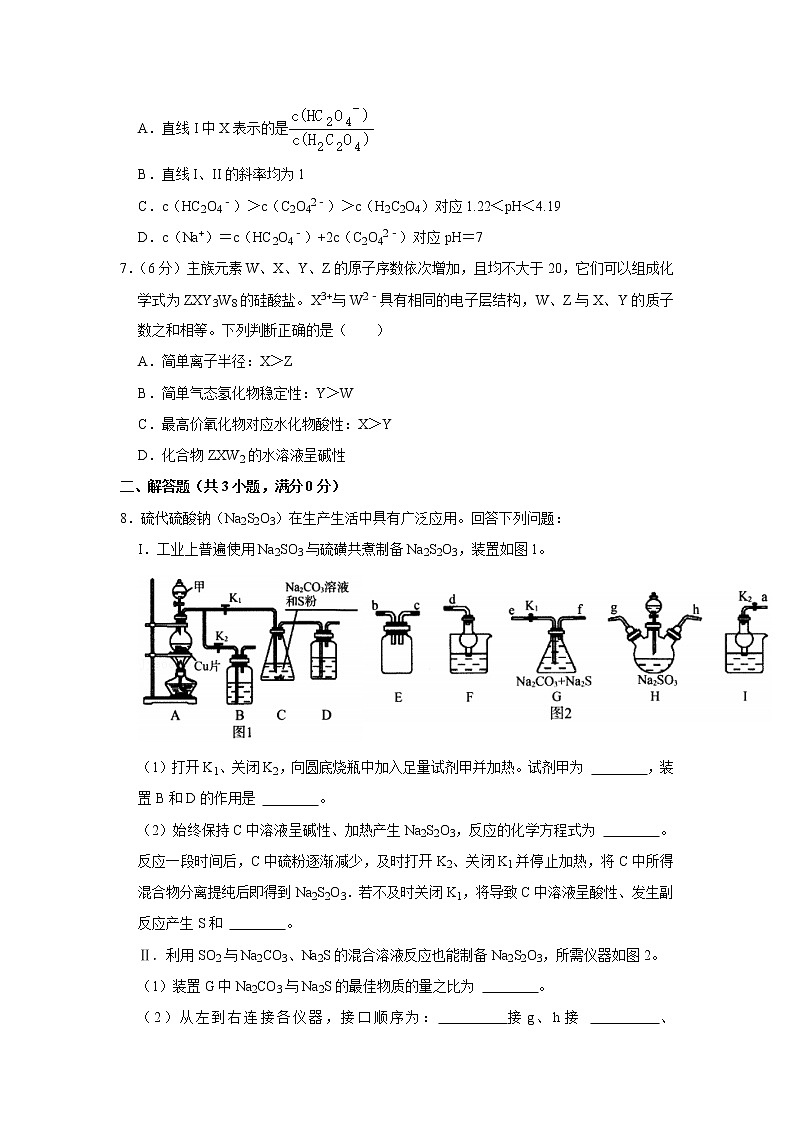
8.硫代硫酸钠(Na2S2O3)在生产生活中具有广泛应用。回答下列问题:
I.工业上普遍使用Na2SO3与硫磺共煮制备Na2S2O3,装置如图1。
(1)打开K1、关闭K2,向圆底烧瓶中加入足量试剂甲并加热。试剂甲为 ,装置B和D的作用是 。
(2)始终保持C中溶液呈碱性、加热产生Na2S2O3,反应的化学方程式为 。反应一段时间后,C中硫粉逐渐减少,及时打开K2、关闭K1并停止加热,将C中所得混合物分离提纯后即得到Na2S2O3.若不及时关闭K1,将导致C中溶液呈酸性、发生副反应产生S和 。
Ⅱ.利用SO2与Na2CO3、Na2S的混合溶液反应也能制备Na2S2O3,所需仪器如图2。
(1)装置G中Na2CO3与Na2S的最佳物质的量之比为 。
(2)从左到右连接各仪器,接口顺序为: 接g、h接 、 接 、 接d。
Ⅲ常用Na2S2O3溶液测定废水中Ba2+浓度。
取废水20.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后用适量稀酸溶解,此时CrO42﹣全部转化为Cr2O72﹣;再加过量KI溶液,将Cr2O72﹣充分反应:Cr2O72﹣+6I﹣+14H+═3I2+2Cr3++7H2O.然后加入淀粉溶液作指示剂,用0.0100ml/L的Na2S2O3溶液进行滴定:I2+2S2O32﹣═S4O62﹣+2I﹣。
当溶液 即为终点。平行滴定3次,消耗Na2S2O3溶液的平均用量为18.00mL,则该废水中Ba2+的物质的量浓度为 。
9.氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属离子[c0(Mn+)=0.1ml/L]形成氢氧化物沉淀的pH范围如下:
③常温下,CaF2、MgF2的溶度积分别为1.46×10﹣10、7.42×10﹣11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为 。
分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为 、氯化铵与锰矿粉的质量之比为 、焙烧时间为 。
(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为 ;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为 ;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中= 。
(3)碳化结晶时,反应的离子方程式为 。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为 。
10.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知:
Fe3 O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H1=a kJ/ml
3Fe2 O3(s)+CO(g)═2Fe3 O4(s)+CO2(g)△H2=bkJ/ml
则反应Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)的△H3= kJ/ml(用含a、b的代数式表示)。
Ⅱ.一定条件下,CO2和CO可以互相转化
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)。
甲容器15min后达到平衡,此时CO2的转化率为75%.则0~15min内平均反应速率v(H2)= ,此条件下该反应的平衡常数K= 。
欲使平衡后乙与甲中相同组分气体的体积分数相等,则ω、x、y、z需满足的关系是 ,且 (用含y的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)⇌C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:
则△H 0(填“>”“<”或“=”),压强力p1、p2、p 3从大到小的顺序是 。
(3)CO可被NO2氧化:CO+NO2⇌CO2+NO.当温度高于225℃时,反应速率v正=k正•c(CO)•c(NO2)、v逆=k逆•c(CO2)•c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为 。
[化学-选修3:物质结构与性质]
11.铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCO2、LiFePO4常用作锂离子电池的正极材料。
基态C原子核外电子排布式为 ,第四电离能I4(C) I4(Fe)(填“>”或<”),PO43﹣的空间构型为 。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。
与CO互为等电子体的分子和离子分别为 和 (各举一种,填化学式);在CO分子中,σ键与π键数目之比为 。
(3)铁与K2O、(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。
在环戊二烯中,C原子的杂化轨道类型为 。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的 化合物。
(4)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
在图a所示堆积方式里,铁原子的半径为rpm,则其晶胞棱长为 cm。
在图b所示堆积方式里,铁原子的总体积占晶体体积的比例为 (用含圆周率π的代数式表示)。
[化学-选修5:有机化学基础]
12.盐酸利多卡因(F)可用于急性心肌梗塞后室性早搏和室性心动过速,合成路线如下:
回答下列问题:
(1)A的化学名称为 。
(2)反应①所需试剂、条件分别为 、 。
(3)B的同分异构体种类很多,符合以下条件的B的同分异构体共有 种(不考虑立体异构)、其中官能团的名称是 。
①属于苯的衍生物,苯环上共有三个取代基;
②与碳酸氢钠溶液反应可放出CO2气体。
(4)C的结构简式为 。
(5)在反应①~⑤中属于取代反应的有 。
(6)ClCH2COCl与足量NaOH溶液共热充分反应的化学方程式为 。
(7)NH(C2H5)2在核磁共振氢谱上有 组峰,峰面积比为 。
2019年四川省广安市、眉山市、内江市、遂宁市高考化学一诊试卷
参考答案与试题解析
一、选择题:本题共7小题,每小题6分,共78分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.(6分)当前,汽车尾气已成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下
下列关于该“消除”过程的叙述不正确的是( )
A.部分光能转变为化学能
B.消除总变化为NO2+O2+H2O→HNO3
C.消除反应能全天候发生
D.使用纳米TiO2的消除效率更高
【分析】含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,在TiO2催化作用下,紫外线提供能量、发生反应4NOx+(5﹣2x)O2+2H2O=4HNO3,纳米TiO2与紫外线接触面积更大,反应更充分,反应速率更快。
【解答】解:A、题中示意图表明:在TiO2催化作用下,紫外线提供能量、发生反应4NOx+(5﹣2x)O2+2H2O=4HNO3,故A正确;
B.分析过程可知消除总变化为4NO2+O2+2H2O=4HNO3,故B正确;
C、没有紫外线时上述反应不能发生,故C错误;
D、纳米TiO2与紫外线接触面积更大,将产生更多的光生电子和光生空穴,从而消除更多的NO2,故D正确
故选:C。
【点评】本题考查了流程分析判断、物质性质分析、反应特征的理解应用,掌握基础是解题关键,题目难度不大。
2.(6分)NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.在6.0gSiO2晶体中,含有的Si﹣O键数目为0.2NA
B.完全燃烧乙酸、葡萄糖混合物6.0g,消耗的O2数目为0.2NA
C.在常温下,1m3pH=4的溶液中由水电离出的H+数目为0.1NA
D.2.24LCl2完全与CH4发生取代反应,生成的HCl数目为0.1NA
【分析】A、求出二氧化硅的物质的量,然后根据二氧化硅中一个硅原子形成4条硅氧键来分析;
B、乙酸和葡萄糖的最简式均为CH2O,而1mlCH2O燃烧消耗1ml氧气;
C、pH=4的溶液是酸溶液还是弱碱强酸盐溶液不明确;
D、氯气所处的状态不明确。
【解答】解:A、6.0g二氧化硅的物质的量为0.1ml,而二氧化硅中一个硅原子形成4条硅氧键,故0.1ml二氧化硅中含0.4NA条硅氧键,故A错误;
B、乙酸和葡萄糖的最简式均为CH2O,故6.0g混合物中含有的CH2O的物质的量为0.2ml,而1mlCH2O燃烧消耗1ml氧气,故0.2mlCH2O燃烧消耗0.2NA个氧气分子,故B正确;
C、pH=4的溶液若是酸溶液,则水电离出的氢离子浓度为10﹣10ml/L,故1000L溶液中,水电离出的氢离子的物质的量为10﹣7ml;而若为强酸弱碱盐溶液,此溶液中水电离出的氢离子浓度为10﹣4ml/L,则1000L溶液中,水电离出的氢离子的个数为0.1NA个,但由于是酸溶液还是弱碱强酸盐溶液不明确,故C错误;
D、氯气所处的状态不明确,故其物质的量无法计算,故D错误。
故选:B。
【点评】本题考查了物质的量和阿伏加德罗常数的有关计算,难度不大,掌握公式的运用和物质的结构是解题关键。
3.(6分)科学家发现半胱氨酸能增强艾滋病毒感染者的免疫力,对控制艾滋病毒的蔓延有奇效。已知半胱氨酸的结构简式为,下列关于半胱氨酸说法不正确的是( )
A.能溶于水、乙醇等溶剂
B.既能与盐酸、又能与NaOH溶液反应
C.与(高半胱氨酸)互为同系物
D.官能团不变的同分异构体有2种
【分析】A、分子间氢键增大了物质的溶解性;
B、半胱氨酸中含有氨基,可与盐酸反应,含有羧基,可与NaOH溶液反应;
C、结构相似,在分子组成上相差一个CH2原子团一系列物质,称同系物。
D、半胱氨酸官能团不变的同分异构体有:巯基与氨基换位,巯基和氨基同在α﹣碳原子上或同在β﹣碳原子上,由此确定同分异构体。
【解答】解:A、半胱氨酸中含有羧基,与水、乙醇分子间能形成氢键(或结构相似),故能溶于水、乙醇等溶剂,故A正确;
B、半胱氨酸中含有氨基,可与盐酸反应,含有羧基,可与NaOH溶液反应,故B正确;
C、高半胱氨酸与半胱氨酸结构相似,在分子组成上相差一个CH2原子团,故C正确;
D、半胱氨酸官能团不变的同分异构体有:巯基与氨基换位,巯基和氨基同在α﹣碳原子上或同在β﹣碳原子上。共有3种,故D错误。
故选:D。
【点评】本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,题目难度不大。
4.(6分)下列实验方案能达到相应实验目的是( )
A.AB.BC.CD.D
【分析】A.还原剂的还原性大于还原产物;
B.比较氯和碳的非金属性强弱,需比较HClO4与H2CO3酸性强弱;
C.溶液的密度不一定是1g•mL﹣1;
D.需做“有Mn2+和无Mn2+时相同H2C2O4溶液与KMnO4酸性溶液的反应的对比实验”,才能证明Mn2+能加快H2C2O4溶液与KMnO4酸性溶液的反应。
【解答】解:A.将KI溶液与FeCl3溶液混合后加入CCl4、CCl4层显紫红色,表明发生了反应2Fe3++2I﹣=2Fe2++I2,即还原性I﹣>Fe2+,故A正确;
B.比较氯和碳的非金属性强弱,需比较HClO4与H2CO3酸性强弱(或HCl与CH4的热稳定性),故B错误;
C.配制100mL 1ml/LCuSO4溶液,需将25gCuSO4•5H2O溶于适量蒸馏水中配成100mL溶液,而不是溶于91mL水,故C错误;
D.要证明Mn2+能加快H2C2O4溶液与KMnO4酸性溶液的反应,需作有Mn2+和无Mn2+时相同H2C2O4溶液与KMnO4酸性溶液的反应的对比实验,故D错误;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、非金属性比较、反应速率、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
5.(6分)中科院深圳先进技术研究院成功研发了一种高效低成本储能电池﹣﹣“铝一石墨”双离子充电电池,电池总反应为Al+xC+Li++PF6ˉAlLi+CxPF6.下列有关该电池的说法正确的是( )
A.放电时,PF6﹣向正极移动
B.放电时,负极反应为Al﹣3e﹣=Al3+
C.充电时,两个电极增加的质量相等
D.充电时,阳极反应为xC+PF6﹣﹣e﹣═CxPF6
【分析】电池充电时的总反应化学方程式为Al+xC+Li++PF6ˉ=AlLi+CxPF6,则放电时的总反应为AlLi+CxPF6=Al+xC+Li++PF6﹣,放电时AlLi被氧化,为原电池的负极,电极反应式为AlLi﹣e﹣=Al+Li+,正极CxPF6得电子被还原,电极反应式为CxPF6+e﹣=xC+PF6﹣,充电时,电极反应与放电时的反应相反,据此分析解答。
【解答】解:A、放电时阴离子移向负极,所以PF6ˉ向负极移动,故A错误;
B、原电池负极反应为LiAl﹣e﹣=Al+Li+,故B错误;
C、充电时电解池阳极反应为xC+PF6﹣﹣e﹣=CxPF6,阴极反应为Al+Li++e﹣=LiAl,两极转移电子的物质的量虽然相等,但增加的质量不相等,故C错误;
D、充电时电解池阳极反应为xC+PF6﹣﹣e﹣=CxPF6,故D正确;
故选:D。
【点评】本题考查化学电源新型电池,为高频考点,明确原电池和电解池原理是解本题关键,难点是电极反应式的书写,注意结合充电时的总反应化学方程式为Al+xC+Li++PF6﹣═AlLi+CxPF6书写,题目难度中等。
6.(6分)草酸(H2C2O4)是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液里lgX[X表示 或]随pH的变化关系如图所示。下列说法不正确的是( )
A.直线I中X表示的是
B.直线I、II的斜率均为1
C.c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)对应1.22<pH<4.19
D.c(Na+)=c(HC2O4﹣)+2c(C2O42﹣)对应pH=7
【分析】A.二元弱酸草酸的K1=>K2=,当lgX=0时,pH=﹣lgc(H+)=﹣lgK,pH1=1.22<pH2=4.19,表明K1=10﹣1.22>K2=10﹣4.19;
B.pH=0时,lg=lgK1=﹣1.22,lg=lgK2=﹣4.19;
C.设pH=a,c(H+)=10﹣a,==10a﹣4.19,当c(C2O42﹣)<c(HC2O4﹣)时,10a﹣4.19<1,即a﹣4.19<0,解得:a<4.19;K1•K2=×=,即==102a﹣5.41,当c(C2O42﹣)>c(H2C2O4)时,102a﹣5.41>1即2a﹣5.41>0,解得a>2.705;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断。
【解答】解:A.二元弱酸草酸的K1=>K2=,当lgX=0时,pH=﹣lgc(H+)=﹣lgK,pH1=1.22<pH2=4.19,表明K1=10﹣1.22>K2=10﹣4.19,所以 直线I中X表示的是,直线Ⅱ中X表示的是
,故A正确;
B.pH=0时,lg=lgK1=﹣1.22,lg=lgK2=﹣4.19,所以直线I、II的斜率均为1,故B正确;
C.设pH=a,c(H+)=10﹣a,==10a﹣4.19,当c(C2O42﹣)<c(HC2O4﹣)时,10a﹣4.19<1,即a﹣4.19<0,解得:a<4.19;K1•K2=×=,即==102a﹣5.41,当c(C2O42﹣)>c(H2C2O4)时,102a﹣5.41>1即2a﹣5.41>0,解得a>2.705,所以c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)对应2.705<pH<4.19,故C错误;
D、电荷守恒:c(Na+)+c(H+)=c(HC2O4ˉ)+2c(C2O42﹣)+c(OHˉ),当c(Na+)=c(HC2O4ˉ)+2c(C2O42﹣)时,c(H+)=c(OHˉ),对应pH=7,故D正确。
故选:C。
【点评】本题考查弱电解质的电离,侧重考查图象分析判断及计算能力,明确电离平衡常数含义及其表达式、计算方法是解本题关键,难点是C选项pH计算,题目难度中等。
7.(6分)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,它们可以组成化学式为ZXY3W8的硅酸盐。X3+与W2﹣具有相同的电子层结构,W、Z与X、Y的质子数之和相等。下列判断正确的是( )
A.简单离子半径:X>Z
B.简单气态氢化物稳定性:Y>W
C.最高价氧化物对应水化物酸性:X>Y
D.化合物ZXW2的水溶液呈碱性
【分析】主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,它们可以组成化学式为ZXY3W8的硅酸盐,必含Si和O,X3+与W2﹣具有相同的电子层结构,W、X分别为O、Al;W、Z与X、Y的质子数之和相等,Y、Z依次为Si、K,据此进行解答。
【解答】解:根据分析可知,W、X、Y、Z依次为O、Al、Si、K,
A.电子层越多,离子半径越大,则离子半径Al3+<K+,故A错误;
B.非金属性越强,简单氢化物的稳定性越强,非金属性Si<O,则简单气态氢化物的稳定性SiH4<H2O,故B错误;
C.非金属性Al<Si,则最高价氧化物对应水化物酸性:H3AlO3<H4SiO4,故C错误;
D.ZXW2为KAlO2,由于AlO2﹣水解,导致KAlO2溶液显碱性,故D正确;
故选:D。
【点评】本题考查原子结构与元素周期律的关系,题目难度不大,推断元素为解答关键,注意掌握元素周期律内容、元素周期表结构,试题培养了学生的分析能力及综合应用能力。
二、解答题(共3小题,满分0分)
8.硫代硫酸钠(Na2S2O3)在生产生活中具有广泛应用。回答下列问题:
I.工业上普遍使用Na2SO3与硫磺共煮制备Na2S2O3,装置如图1。
(1)打开K1、关闭K2,向圆底烧瓶中加入足量试剂甲并加热。试剂甲为 浓硫酸 ,装置B和D的作用是 吸收SO2,防止污染空气 。
(2)始终保持C中溶液呈碱性、加热产生Na2S2O3,反应的化学方程式为 S+SO2+Na2CO3 Na2S2O3+CO2 。反应一段时间后,C中硫粉逐渐减少,及时打开K2、关闭K1并停止加热,将C中所得混合物分离提纯后即得到Na2S2O3.若不及时关闭K1,将导致C中溶液呈酸性、发生副反应产生S和 NaHSO3 。
Ⅱ.利用SO2与Na2CO3、Na2S的混合溶液反应也能制备Na2S2O3,所需仪器如图2。
(1)装置G中Na2CO3与Na2S的最佳物质的量之比为 1:2 。
(2)从左到右连接各仪器,接口顺序为: a 接g、h接 b 、 c 接 e 、 f 接d。
Ⅲ常用Na2S2O3溶液测定废水中Ba2+浓度。
取废水20.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后用适量稀酸溶解,此时CrO42﹣全部转化为Cr2O72﹣;再加过量KI溶液,将Cr2O72﹣充分反应:Cr2O72﹣+6I﹣+14H+═3I2+2Cr3++7H2O.然后加入淀粉溶液作指示剂,用0.0100ml/L的Na2S2O3溶液进行滴定:I2+2S2O32﹣═S4O62﹣+2I﹣。
当溶液 蓝色褪去且在半分钟内不恢复 即为终点。平行滴定3次,消耗Na2S2O3溶液的平均用量为18.00mL,则该废水中Ba2+的物质的量浓度为 0.00300ml/L 。
【分析】I.(1)A为二氧化硫的制备装置,C制取Na2S2O3,二氧化硫有毒,装置B和D中需盛碱液(如NaOH溶液),用于吸收SO2,防止污染空气;
(2)C中反应物SO2、Na2CO3溶液和硫粉,根据题意首先SO2和Na2CO3溶液发生反应生成Na2SO3和CO2,Na2SO3和S制Na2S2O3,不及时关闭K1,将导致C中溶液呈酸性而发生副反应Na2S2O3+SO2+H2O=2NaHSO3+S↓;
Ⅱ.(1)装置G中Na2CO3与Na2S的最佳物质的量之比由反应方程式中化学计量数之比确定;
(2)按I(实验后期关闭K1,打开K2可吸收多余SO2)→H(制取SO2)→E(安全装置)→G(制取Na2S2O3)→F(吸收SO2尾气)确定连接装置的顺序。
Ⅲ.碘遇到淀粉呈蓝色,终点为蓝色褪去且在半分钟内不恢复;
按关系式:2Ba2+~2BaCrO4~Cr2O72﹣~3I2~6S2O32﹣计算n(Ba2+),再由c=计算浓度。
【解答】解:I.(1)A为二氧化硫的制备装置,故试剂甲为浓硫酸,装置B和D中需盛碱液(如NaOH溶液),用于吸收SO2,防止污染空气,
故答案为:浓硫酸;吸收SO2,防止污染空气;
(2)C中反应物SO2、Na2CO3溶液和硫粉,根据题意首先SO2和Na2CO3溶液发生反应生成Na2SO3和CO2,Na2SO3和S制Na2S2O3,总反应为:S+SO2+Na2CO3 Na2S2O3+CO2;
若不及时关闭K1,将导致C中溶液呈酸性而发生副反应Na2S2O3+SO2+H2O=2NaHSO3+S↓,
故答案为:S+SO2+Na2CO3 Na2S2O3+CO2;NaHSO3;
Ⅱ.(1)装置G中发生反应的方程式为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2,故Na2CO3和Na2S的最佳物质的量之比为1:2,
故答案为:1:2;
(2)需按下列顺序连接装置,I(实验后期关闭K1,打开K2可吸收多余SO2)→H(制取SO2)→E(安全装置)→G(制取Na2S2O3)→F(吸收SO2尾气),所以各接口的顺序为:a接g、h接b、c接e、f接d,
故答案为:a;b;c;e;f;
Ⅲ.向碘的淀粉蓝色溶液中滴加Na2S2O3溶液,滴定终点为蓝色褪去且在半分钟内不恢复。
相关物质转化的关系式为:2Ba2+~2BaCrO4~Cr2O72﹣~3I2~6S2O32﹣,n(Ba2+)=n(S2O32﹣)×=18.00mL×0.001L/mL×0.0100ml/L×=0.06×10﹣3ml,c(Ba2+)==0.00300ml/L,
故答案为:蓝色褪去且在半分钟内不恢复;0.00300ml/L。
【点评】本题考查物质的制备实验,为高频考点,把握物质的性质、发生的反应、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大。
9.氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属离子[c0(Mn+)=0.1ml/L]形成氢氧化物沉淀的pH范围如下:
③常温下,CaF2、MgF2的溶度积分别为1.46×10﹣10、7.42×10﹣11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为 MnCO3+2NH4ClMnCl2+2NH3↑+CO2↑+H2O 。
分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为 500℃ 、氯化铵与锰矿粉的质量之比为 1.10 、焙烧时间为 60min 。
(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O ;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为 5.2≤pH<8.8 ;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中= 1.97 。
(3)碳化结晶时,反应的离子方程式为 Mn2++2HCO3﹣MnCO3+CO2↑+H2O 。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为 Mn2++2H2O﹣2e﹣=MnO2+4H+ 。
【分析】菱锰矿的主要成分为MnCO3,加入氯化铵焙烧发生MnCO3+2NH4Cl MnCl2+CO2↑+2NH3↑+H2O↑,气体为二氧化碳和氨气、水蒸气,浸出液中含MnCl2、FeCl2、CaCl2、MgCl2、AlCl3等,结合表中离子的沉淀pH及信息可知,浸取液净化除杂时加入少量MnO2氧化亚铁离子为铁离子,加氨水调pH,生成沉淀氢氧化铁和氢氧化铝,加入NH4F,除去Ca2+、Mg2+,净化液加入碳酸氢铵碳化结晶过滤得到碳酸锰,
(1)NH4Cl分解为NH3、HCl,HCl与MnCO3反应得到MnCl2、CO2、H2O,由此写出方程式;结合图1、图2、图3,判断锰浸出率选择最佳条件;
(2)MnO2在酸性条件下将Fe2+氧化为Fe3+;
欲使Al3+、Fe3+变为沉淀除去,溶液pH≥5.2,不使Mn2+沉淀,pH<8.8,从而确定pH范围,用平衡常数计算两种沉淀共存时溶液中;
(3)碳化结晶时,可看成Mn(HCO3)2受热分解,类比写出离子方程;
(4)阳极得到重要的无机功能材料MnO2,失电子发生氧化反应。
【解答】解:(1)NH4Cl分解为NH3、HCl,HCl与MnCO3反应得到MnCl2、CO2、H2O,反应方程式为MnCO3+2NH4ClMnCl2+2NH3↑+CO2↑+H2O;
氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为500℃、氯化铵与锰矿粉的质量之比为1.10、焙烧时间为60min,
故答案为:MnCO3+2NH4ClMnCl2+2NH3↑+CO2↑+H2O;500℃;1.10;60min;
(2)MnO2在酸性条件下将Fe2+氧化为Fe3+,离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
欲使Al3+、Fe3+变为沉淀除去,溶液pH≥5.2,不使Mn2+沉淀,pH<8.8,溶液pH的范围为5.2≤pH<8.8;
加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中==1.97,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;5.2≤pH<8.8;1.97;
(3)可看成Mn(HCO3)2受热分解,离子方程式为:Mn2++2HCO3﹣MnCO3+CO2↑+H2O,
故答案为:Mn2++2HCO3﹣MnCO3+CO2↑+H2O;
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在阳极得到重要的无机功能材料MnO2,该电极的电极反应式为Mn2++2H2O﹣2e﹣=MnO2+4H+,阴极反应为:2H++2e﹣=H2↑,
故答案为:Mn2++2H2O﹣2e﹣=MnO2+4H+。
【点评】本题考查物质的制备实验,为高频考点,把握物质的性质、发生的反应、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识及反应原理与实验的结合,题目难度不大。
10.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知:
Fe3 O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H1=a kJ/ml
3Fe2 O3(s)+CO(g)═2Fe3 O4(s)+CO2(g)△H2=bkJ/ml
则反应Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)的△H3= (b+2a) kJ/ml(用含a、b的代数式表示)。
Ⅱ.一定条件下,CO2和CO可以互相转化
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)。
甲容器15min后达到平衡,此时CO2的转化率为75%.则0~15min内平均反应速率v(H2)= 0.2ml/(L•min) ,此条件下该反应的平衡常数K= 1.8 。
欲使平衡后乙与甲中相同组分气体的体积分数相等,则ω、x、y、z需满足的关系是 x=2w+y ,且 z=y (用含y的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)⇌C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:
则△H > 0(填“>”“<”或“=”),压强力p1、p2、p 3从大到小的顺序是 p1>p2>p3 。
(3)CO可被NO2氧化:CO+NO2⇌CO2+NO.当温度高于225℃时,反应速率v正=k正•c(CO)•c(NO2)、v逆=k逆•c(CO2)•c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为 K= 。
【分析】Ⅰ.已知:①Fe3 O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H1=a kJ/ml
②3Fe2 O3(s)+CO(g)═2Fe3 O4(s)+CO2(g)△H2=bkJ/ml
根据盖斯定律,可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)据此计算△H3;
Ⅱ(1)甲容器15min后达到平衡,此时CO2的转化率为75%,转化的二氧化碳为:8ml×75%=6ml,
CO2(g)+H2(g)⇌CO(g)+H2O(g)
初始(ml)8 16 0 0
转化(ml)6 6 6 6
平衡(ml)2 10 6 6
结合c=计算v(H2);由K=c(CO)•c(H2O)/c(CO2)•n(H2)计算平衡常数;
欲使平衡后乙与甲中相同组分气体的体积分数相等,则ω、x、y、z需满足的关系(w﹣y):(x﹣y)=8:16,且z=y;
(2)压强越大,乙苯的平衡转化率越小;
(3)达平衡时v正=v逆,即k正•c(CO)•c(NO2)=k逆•c(CO2)•c(NO),由此计算。
【解答】解:Ⅰ.已知:①Fe3 O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H1=a kJ/ml
②3Fe2 O3(s)+CO(g)═2Fe3 O4(s)+CO2(g)△H2=bkJ/ml
根据盖斯定律,可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H3=(△H1+2△H2)×=(b+2a)kJ/ml,
故答案为:(b+2a);
Ⅱ(1)甲容器15min后达到平衡,此时CO2的转化率为75%,转化的二氧化碳为:8ml×75%=6ml,
CO2(g)+H2(g)⇌CO(g)+H2O(g)
初始(ml)8 16 0 0
转化(ml)6 6 6 6
平衡(ml)2 10 6 6
0~15min内平均反应速率v(H2)==0.2ml/(L•min);
该稳定性该反应的平衡常数K==l.8;
平衡后乙与甲中相同组分气体的体积分数相等,说明甲和乙互为等效平衡,需必须满足(w﹣y):(x﹣y)=8:16,整理可得:x=2w+y且z=y,
故答案为:0.2ml/(L•min);l.8;x=2w+y;z=y;
(2)根据图象可知,温度越高、乙苯的平衡转化率越大,表明△H>0;
该反应的△n气>0,则压强越大,乙苯的平衡转化率越小,故p1>p2>p3,
故答案为:>;p1>p2>p3;
(3)达平衡时v正=v逆,即k正•c(CO)•c(NO2)=k逆•c(CO2)•c(NO),故==K,
故答案为:K=。
【点评】本题考查化学平衡的计算、盖斯定律的应用等知识,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的分析能力及化学计算能力。
[化学-选修3:物质结构与性质]
11.铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCO2、LiFePO4常用作锂离子电池的正极材料。
基态C原子核外电子排布式为 [Ar]3d74s2 ,第四电离能I4(C) < I4(Fe)(填“>”或<”),PO43﹣的空间构型为 正四面体 。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。
与CO互为等电子体的分子和离子分别为 N2 和 CN﹣ (各举一种,填化学式);在CO分子中,σ键与π键数目之比为 1:2 。
(3)铁与K2O、(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。
在环戊二烯中,C原子的杂化轨道类型为 sp2和sp3 。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的 共价 化合物。
(4)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
在图a所示堆积方式里,铁原子的半径为rpm,则其晶胞棱长为 cm。
在图b所示堆积方式里,铁原子的总体积占晶体体积的比例为 .π (用含圆周率π的代数式表示)。
【分析】(1)C为27号元素,根据构造原理写出原子核外电子排布式;
C3+核外电子排布为不稳定结构3d6、较易失去电子,Fe3+核外电子排布为半满稳定结构3d5,较难失电子,由此比较第4电离能;
PO43﹣中P原子孤电子对数为0、σ键数目为4,由此确定空间构型;
(2)价电子数和原子数相等的粒子互为等电子体;CO与N2的结构相似,σ键、π键数分别为1、2;
(3)在环戊二烯中有4个C原子为sp2杂化,1个C原子为sp3杂化;二茂铁的熔点不高、溶解性情况包括能升华等性质与分子晶体相似;即二茂铁由分子构成,是共价化合物;
(4)图a晶胞为体心立方堆积,设晶胞棱长为x,则4rpm= x,求出x;
图b晶胞为面心立方最密堆积,设b晶胞棱长为y,Fe原子半径为R,4R= y,再结合球体积公式计算。
【解答】解:(1)C为27号元素,原子核外电子排布式为[Ar]3d74s2;
C3+核外电子排布为不稳定结构3d6、较易失去电子,所以第四电离能较小;而Fe3+核外电子排布为半满稳定结构3d5,较难失电子,所以第4电离能较大;
PO43﹣中P原子孤电子对数为0、σ键数目为4,所以PO43﹣的空间构型为正四面体;
故答案为:[Ar]3d74s2,<,正四面体;
(2)CO的价电子数为(4+6)=10,原子数为2,10=5×2=5+7﹣1=(4+1)×2等,所以CO的等电子体为N2、CN﹣、NO+、C2﹣ 等;
CO与N2的结构相似,根据N2的结构式N≡N可知,CO分子中含有一个σ键、两个π键数,所以在CO分子中,σ键与π键数目之比为1:2;
故答案为:N2,CN﹣,1:2;
(3)在环戊二烯中有4个C原子为sp2杂化,1个C原子为sp3杂化;根据二茂铁的熔点不高、溶解性情况包括能升华等性质与分子晶体相似,即二茂铁由分子构成,是共价化合物;
故答案为:sp2和sp3,共价;
(4)设图a晶胞棱长为x,4rpm= x,x=pm=cm;
设图b晶胞棱长为y,Fe原子半径为R,晶胞中Fe数目为8×+6×=4,4R= y,R=,球体积V==×=,原子的总体积占晶体体积的比例==π;
故答案为:; π。
【点评】本题考查原子结构结构、分子性质、晶体类型,侧重考查核外电子排布式、电离能、等电子体、粒子空间构型、杂化方式、晶胞计算等,综合性强,知识点多,题目难度中等,掌握基础知识是关键,注意晶胞的相关计算步骤和方法。
[化学-选修5:有机化学基础]
12.盐酸利多卡因(F)可用于急性心肌梗塞后室性早搏和室性心动过速,合成路线如下:
回答下列问题:
(1)A的化学名称为 间二甲苯(或1,3﹣二甲苯) 。
(2)反应①所需试剂、条件分别为 浓硝酸、浓硫酸 、 加热 。
(3)B的同分异构体种类很多,符合以下条件的B的同分异构体共有 10 种(不考虑立体异构)、其中官能团的名称是 氨基、羧基 。
①属于苯的衍生物,苯环上共有三个取代基;
②与碳酸氢钠溶液反应可放出CO2气体。
(4)C的结构简式为 。
(5)在反应①~⑤中属于取代反应的有 ①③④ 。
(6)ClCH2COCl与足量NaOH溶液共热充分反应的化学方程式为 。
(7)NH(C2H5)2在核磁共振氢谱上有 3 组峰,峰面积比为 6:4:1 。
【分析】A发生取代反应生成B,C发生取代反应生成D,根据BD结构简式知,B发生还原反应生成C为;D发生取代反应生成E;
(1)A为间二甲苯(或1,3﹣二甲苯);
(2)反应①是在苯环上引入硝基,需要浓硫酸作催化剂、加热;
(3)满足题给要求的同分异构体必含有一COOH(羧基),一NH2(氨基)和一CH3,可能三者紧邻、两者紧邻、三者均不相邻三种情况,找出同分异构体的数目;
(4)综合B、D的结构判断C结构简式;
(5)反应①为A中苯环上一个H原子被硝基取代,反应③为C中氨基上的一个H原子被一CH2COCl取代,反应④为D中的氯原子被一N(C2H5)2取代;
(6)ClCH2COCl水解得到HOCH2COOH,HOCH2COOH再与NaOH发生中和反应,写出方程式。
(7)将NH3中的两个氢原子换成﹣C2H5,NH(C2H5)2,这两个﹣C2H5的空间环境相同。
【解答】解:(1)A为间二甲苯(或1,3﹣二甲苯),故答案为:间二甲苯(或1,3﹣二甲苯);
(2)反应①是在苯环上引入硝基,需要浓硫酸作催化剂、浓硝酸作反应物,还需要加热,所需试剂为浓硝酸/浓硫酸,条件为加热,
故答案为:浓硝酸/浓硫酸;加热;
(3)满足题给要求的同分异构体必含有一COOH(羧基),一NH2(氨基)和一CH3,如果三者紧邻,有3种结构,如果两者紧邻,有3种紧邻方式、每种相邻方式又有2种结构,即2×3=6种结构,如果三者均不相邻,只有1种结构,共有10种结构,其官能团名称是氨基、羧基,
故答案为:10;氨基、羧基;
(4)综合B、D的结构,可知C是,
故答案为:;
(5)反应①为A中苯环上一个H原子被硝基取代,反应③为C中氨基上的一个H原子被一CH2COCl取代,反应④为D中的氯原子被一N(C2H5)2取代,属于取代反应的是①③④,
故答案为:①③④;
(6)ClCH2COCl水解得到HOCH2COOH,HOCH2COOH再与NaOH发生中和反应生成HOCH2COONa,反应方程式为:。
(7)将NH3中的两个氢原子换成﹣C2H5,NH(C2H5)2,这两个﹣C2H5的空间环境相同,故有3种氢原子,三者物质的量之比为6:4:1,
故答案为:3;6:4:1。
【点评】本题考查有机物推断,侧重考查分析判断、逆向思维及知识综合运用能力,明确官能团结构和性质关系、官能团之间的转化关系是解本题关键,难点是同分异构体种类判断,同分异构体有碳链异构、官能团异构、位置异构,题目难度中等。编号
实验目的
实验方案
A
验证Fe2+还原性弱于I﹣
将KI溶液于FeCl3溶液混合后加入CCl4
B
比较氯和碳的非金属性强弱
将稀盐酸滴入NaHCO3溶液中
C
配制100mL 1ml/LCuSO4溶液
将25g CuSO4•5H2O溶于91mL蒸馏水中
D
Mn2+能加快H2C2O4溶液与KMnO4酸性溶液的反应
将4mL 0.01ml/L KMnO4酸性溶液和2mL 0.1ml/L H2C2O4溶液混合
金属离子
Al3+
Fe3+
Fe2+
Ca2+
Mn2+
Mg2+
开始沉淀的pH
3.8
1.5
6.3
10.6
8.8
9.6
沉淀完全的pH
5.2
2.8
8.3
12.6
10.8
11.6
容器
反应物
甲
8ml CO2(g)、16ml H2(g)
乙
w ml CO2(g)、x ml H2(g)、y mlCO(g)、z ml H2O(g)
编号
实验目的
实验方案
A
验证Fe2+还原性弱于I﹣
将KI溶液于FeCl3溶液混合后加入CCl4
B
比较氯和碳的非金属性强弱
将稀盐酸滴入NaHCO3溶液中
C
配制100mL 1ml/LCuSO4溶液
将25g CuSO4•5H2O溶于91mL蒸馏水中
D
Mn2+能加快H2C2O4溶液与KMnO4酸性溶液的反应
将4mL 0.01ml/L KMnO4酸性溶液和2mL 0.1ml/L H2C2O4溶液混合
金属离子
Al3+
Fe3+
Fe2+
Ca2+
Mn2+
Mg2+
开始沉淀的pH
3.8
1.5
6.3
10.6
8.8
9.6
沉淀完全的pH
5.2
2.8
8.3
12.6
10.8
11.6
容器
反应物
甲
8ml CO2(g)、16ml H2(g)
乙
w ml CO2(g)、x ml H2(g)、y mlCO(g)、z ml H2O(g)
2023化学焦作高三一模答案: 这是一份2023化学焦作高三一模答案,共2页。
2020届四川省遂宁高三一模化学试卷及答案: 这是一份2020届四川省遂宁高三一模化学试卷及答案,共10页。试卷主要包含了4g时,正极消耗3等内容,欢迎下载使用。
2020年四川省泸州高三一模化学试卷及答案: 这是一份2020年四川省泸州高三一模化学试卷及答案,共28页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












