






所属成套资源:新教材苏教版高中化学选择性必修一同步课件PPT
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化示范课课件ppt
展开
这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化示范课课件ppt,共22页。PPT课件主要包含了化学电源的分类,普通锌锰干电池,一次电池,碱性锌锰干电池,银锌纽扣电池,铅蓄电池,PbO2,硫酸溶液,二次电池,②原理等内容,欢迎下载使用。
化学电源包括一次电池、二次电池、以及燃料电池等
一次电池:反生氧化还原反应的物质大部分被消耗后就不能再使用的电池。
二次电池:放电后可以再充电使活性物质再生,可多次重复使用。
燃料电池:利用燃料和氧化剂之间发生的氧化还原反应,将化学能 直接转化为电能。
包括:普通锌锰干电池、碱性锌锰干电池、银锌纽扣电池等
包括:铅蓄电池、、镍铬电池、锂电池、锂离子电池等
包括:氢氧燃料电池、甲烷、甲醇、肼(N2H4)、氨等
负极:Zn-2e- + 2NH4+ = [Zn(NH3)2]2+ + 2H+ 正极:MnO2 + H+ + e - =MnOOH
总反应为: Zn+2MnO2+2NH4Cl==Zn(NH3)2Cl2 + 2MnOOH
优点:制作简单,价格便宜缺点:放电时间短,放电后电压下降快
氯化铵溶液显酸性,会跟锌皮发生反应,使用一段时间后电池会鼓胀,漏液。后来把氯化铵换成了碱性的物质,制成了碱性锌锰干电池
总反应为: Zn+2MnO2+2H2O==Zn(OH)2+ 2MnOOH
你能书写该电池的电极反应式吗?
负极:Zn-2e- + 2OH - = Zn(OH)2 正极:MnO2 + H2O + e - =MnOOH + OH -
优点:克服了普通锌锰干电池的缺点,比能量大,能提供较大电流并持续放电
总反应为:Zn +Ag2O + H2O == 2Ag + Zn(OH)2
负极:Zn-2e-+ 2OH-==Zn(OH)2 正极:Ag2O + H2O +2e-==2Ag + 2OH-
试着书写该电池的电极反应式
优点:电池比能量大,电压稳定,存储时间长,适宜小电流持续放电
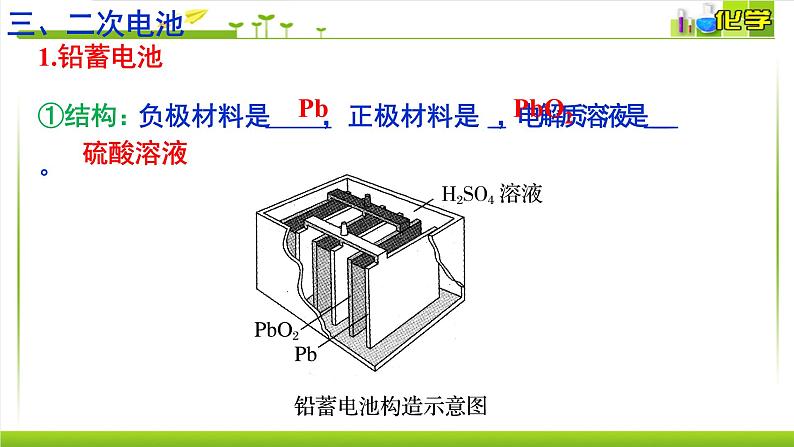
①结构:负极材料是 ,正极材料是 ,电解质溶液是 。
负极: Pb- 2e-+ SO4 2 - =PbSO4
正极: PbO2+4H++SO42- + 2e- = PbSO4 +2H2O
PbSO4 =Pb+ SO42-
PbSO4 +2H2O = PbO2 + 4H++ SO42-
阴极: 与外接电源负极相连
阳极: 与外接电源正极相连
铅蓄电池的充、放电原理可以用下列化学方程式表示:
由铅蓄电池的电池反应可以看出,随着放电反应的进行,硫酸的浓度不断下降,密度不断减小,人们常常根据硫酸密度的大小来判断铅蓄电池是否需要充电。
铅蓄电池性能优良,安全可靠,价格低廉;但是其比能量低、笨重,废弃电池污染环境。
随着信息技术的发展,我们更青睐小型化、高比能量、工作寿命长、不需要特殊维护的二次电池。目前已开发出镍铬电池、镍氢电池、锂电池、锂离子电池。
①氧化剂与还原剂在工作时不断补充; ②反应产物不断排出; ③能量转化率高(超过80%),普通的只有30%,有利于节约能源。 缺点:体积较大、附属设备较多 优点:能量转换率高、清洁、对环境好 种类:氢氧燃料电池、甲烷、烃、肼、甲醇、氨、煤气燃料电池……
1.燃料电池与前几种电池的差别:
2. 燃料电池的规律:
①燃料做负极,助燃剂氧气为正极 ②电极材料一般不参加化学反应,只起传导电子的作用。
原理:根据2H2+O2===2H2O,使燃料(H2)与氧化剂(O2)分别在两个电极上发生氧化反应和还原反应。
电极材料: Pt或石墨制作的惰性电极
电解质溶液: 分为酸性溶液和碱性溶液
负极:2H2-4e-===4H+
正极:O2+4H++4e-===2H2O
思考:电池工作一段时间后,上述溶液的pH如何变化?
当电解质溶液: 硫酸溶液
反应生成水,硫酸溶液酸性减弱,pH变大。
写出正、负极电极反应式:
当电解质溶液: KOH溶液
正极:O2+2H2O+4e-=4OH-
负极:2H2+4OH--4e-=4H2O
思考:电池工作一段时间后,正极侧、负极侧和电解质溶液的pH如何变化?
写出正负极电极反应式:
正极pH增大,负极pH减小,整个溶液的pH减小。
氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、甲醇、汽油等。
请写出甲醇酸性、碱性燃料电池的电极反应式
碱性条件化学方程式:2CH3OH + 3O2 + 4OH-= 2CO32- + 6H2O
正极:O2 + 4e-+ 2H20 = 4OH-
负极:CH3OH - 6e- + 8OH- =CO32- + 6H2O
酸性条件
化学方程式:2CH3OH +3O2=2CO2+4H2O
正极:O2 + 4e- + 4H+ = 2H2O
负极:CH3OH - 6e- + H2O = 6H+ + CO2
熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池。氢气和氧气以及熔融态碳酸盐形成的燃料电池。
(3)熔融碳酸盐燃料电池
H2-2e- =H2O
O2+4e- =
1.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4溶液,电池放电时的反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,下列对电池放电时的分析正确的是( )A.Pb为正极被氧化B.电子从PbO2流向外电路C.SO42-向PbO2处移动D.电解质溶液pH不断增大
2.(双选)如图是甲醇(CH3OH)燃料电池的化学原理示意图,下列判断不正确的是( )
A.电极A为电池负极B.电极B表面上发生氧化反应C.工作一段时间溶液pH保持不变D.燃料电池工作时不会出现火焰
3.研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。总反应为2Li+2H2O===2LiOH+H2↑。(1)该电池的负极是锂,负极反应式是 。(2)正极现象是 。(3)放电时OH-向 (填“正极”或“负极”)移动。
相关课件
这是一份化学选择性必修1第一节 原电池精品课件ppt,文件包含412化学电源练习解析版docx、412化学电源练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份人教版 (2019)选择性必修1第四章 化学反应与电能第一节 原电池优秀课件ppt,文件包含人教版高中化学选择性必修一412化学电源课件pptx、人教版高中化学选择性必修一412化学电源学案docx等2份课件配套教学资源,其中PPT共32页, 欢迎下载使用。
这是一份化学第二单元 物质的化学计量完美版ppt课件,共32页。PPT课件主要包含了学习目标,物质的聚集状态,知识梳理,mol物质的体积,密度Vmρ,分析表中数据得到结论,粒子数目,粒子间距,粒子大小,约1700倍等内容,欢迎下载使用。










