



人教版 (2019)选择性必修1第二节 电解池教学课件ppt
展开水质电解器真的可以区分水质好坏?
原电池中的能量转化方式是什么?
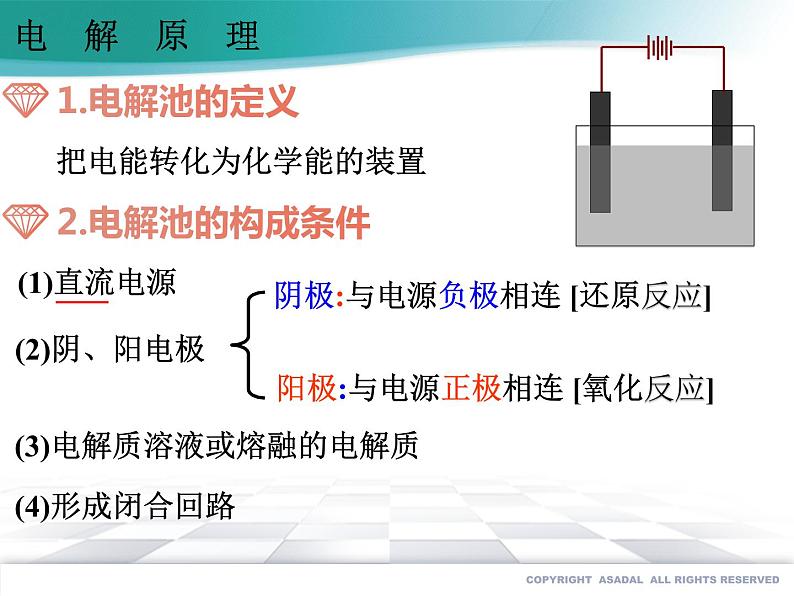
把电能转化为化学能的装置
阴极:与电源负极相连 [还原反应]
阳极:与电源正极相连 [氧化反应]
(3)电解质溶液或熔融的电解质
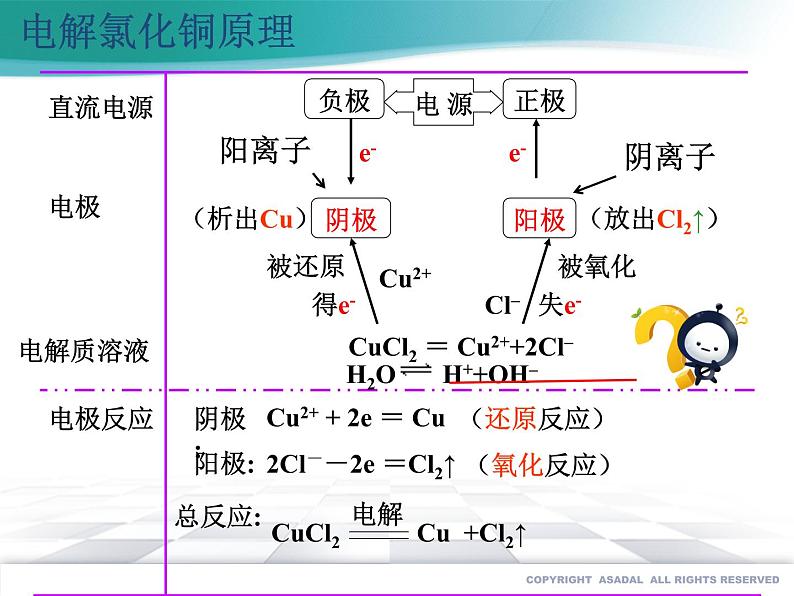
Cu2+ + 2e = Cu
2Cl--2e =Cl2↑
CuCl2 = Cu2++2Cl–
H2O H++OH–
②一定是电解质溶液中阳离子“争”得电子
(1)阴极:得电子,还原反应
①电极本身不参加反应
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)> Al3+>Mg2+>Na+>Ca2+>K+
阳离子在阴极上放电顺序是:
②若为惰性电极,电解质溶液中阴离子“争”失电子
(2)阳极:失电子,氧化反应
①若为金属(非惰性)电极,电极失电子
金属在阳极失电子被氧化成阳离子进入溶液,阴离子不容易在电极上放电。
S 2->SO32->I ->Br ->Cl ->OH ->NO3 ->SO42-(等含氧酸根离子)>F-
石墨电极、金电极、铂电极
明确溶液中存在哪些离子
根据阳极氧化、阴极还原以及氧化性、还原性强弱判断反应的离子先后,最后分析得出产物
阴阳两极附近有哪些离子
分析电解反应(用惰性电极时)的一般思路:
阳极:2Cl- - 2 e- = Cl2↑
阴极:Cu2+ + 2e-= Cu
CuCl2 = Cu2+ + 2Cl-
阳极: 2Cl- - 2e- = Cl 2↑
阴极: 2H ++ 2e- =H2 ↑
总反应:2NaCl+2H2O 2NaOH+H2 ↑ + Cl2 ↑
NaCl = Na+ + Cl-
3.电解池电极反应规律
4.电解池电极反应式的书写
2.完成导学案P86-P87
3.预习电解原理的应用
4.书写电解CuSO4溶液的电极式
阳极: 4OH- - 4e- = 2H2O+O2 ↑
阴极:Cu2++ 2e- = Cu
CuSO4 = Cu2+ + SO42-
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ与Ⅲ区:电解本身型 如CuCl2 、HClⅠ与Ⅳ区:放氢生碱型 如NaClⅡ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3Ⅱ与Ⅳ区:电解水型 如Na2SO4、H2SO4 、NaOH
阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>(H+) >Al3+>Mg2+>Na+
一、电解质溶液用惰性电极电解的示例
如电解H2SO4、HNO3、NaOH、Na2SO4等溶液时其电极反应式为:
电解后溶液中溶质的质量分数增大,若要恢复原来的浓度,只需加入一定量的水即可。
用惰性电极电解电解质溶液规律
如电解盐酸、CuCl2溶液等
电解后溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量的溶质(通入一定量的HCl气体)
如电解CuSO4溶液、AgNO3溶液等。
电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量金属氧化物。
如电解NaCl、KCl、MgCl2 、AlCl3 溶液等。
电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需通入一定量的HCl气体。
阳极:4OH- -4e- = O2 ↑+2H2O阴极:4H+ + 4e- = 2H2↑
阳极:2Cl- -2e- = Cl2↑阴极:2H++2e- = H2↑
阳极:2Cl- -2e- = Cl2↑阴极:Cu2++2e- = Cu↓
阳极:2Cl- - 2e- = Cl2↑阴极:2H++2e- = H2↑
阳极:4OH- - 4e- = O2↑+2H2O阴极:2Cu2++4e- = 2Cu↓
二、原电池与电解池的比较
两个电极;电解质;闭合回路;一般能自发进行氧化还原反应
电源;两个电极;电解质;闭合回路;电源
外电路:电子的定向移动内电路:离子的定向移动
阴离子向阳极迁移,阳离子向阴极迁移
阴离子向负极迁移,阳离子向正极迁移
高中化学人教版 (2019)选择性必修1第二节 电解池完美版ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池完美版ppt课件,共30页。
高中化学人教版 (2019)选择性必修1第二节 电解池备课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池备课ppt课件,文件包含421电解池教学课件高二化学同步备课系列人教版2019选择性必修1pptx、421电解池解析版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、421电解池原卷版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx等3份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
4.2.1 电解原理(课件)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(共33页PPT): 这是一份4.2.1 电解原理(课件)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(共33页PPT),共1页。













