






反应热的计算PPT课件免费下载2023
展开一、【课程的主要内容】
(一)内容:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。这就是盖斯定律。
(二)内涵:在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
(三)对盖斯定律的理解
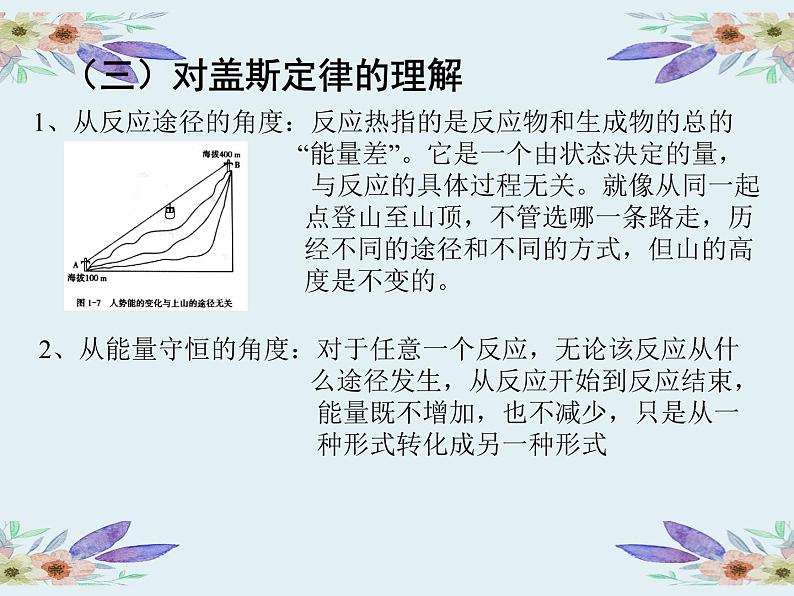
1、从反应途径的角度:反应热指的是反应物和生成物的总的 “能量差”。它是一个由状态决定的量, 与反应的具体过程无关。就像从同一起 点登山至山顶,不管选哪一条路走,历 经不同的途径和不同的方式,但山的高 度是不变的。
2、从能量守恒的角度:对于任意一个反应,无论该反应从什 么途径发生,从反应开始到反应结束, 能量既不增加,也不减少,只是从一 种形式转化成另一种形式
对于有些反应进行得很慢,有些反应不容易直接发生,有些反应的产物不纯(有副反应发生)这些类反应,可应用盖斯定律间接的把它们的反应热计算出来
(一)利用热量求反应热
【例题1】黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)在25℃和101kPa时,1 ml FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。(1)请写出FeS2燃烧的热化学方程式。(2)计算理论上1kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量。
【解】(1)根据题意,FeS2燃烧的热化学方程式为FeS2(s)+11/4O(g)=1/2Fe2O3(s)+2SO2(g) ∆H=-853 kJ/ml(2)FeS2的摩尔质量为120g·ml-1。1kg黄铁矿含FeS2的质量为:1000g×90%=900g900gFeS2的物质的量为:理论上1kg黄铁矿完全燃烧放出的热量为:7.5 ml x 853 kJ/ml=6 398 kJ答:(1)FeS2燃烧的热化学方程式为:FeS2(s)+11/4O2(g)=1/2Fe2O3(s)+2SO2(g) ∆H=-853 kJ/ml(2)理论上1kg黄铁矿完全燃烧放出的热量为6398kJ。
二、【拓展学习】
(二)利用热化学方程式和盖斯定律求反应热
【例题1】葡萄糖是人体所需能量的重要来源之一,设它在人体组织中完全氧化时的热化学方程式为:C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(1) △H=-2800kJ/ml计算100g葡萄糖在人体组织中完全氧化时产生的热量。
【解】根据热化学方程式可知,1mlC6H12O6在人体组织中完全氧化时产生的热量为2800kJ。C6H12O6的摩尔质量为180g·ml-1。100gC6H12O6的物质的量为:0.556 ml C6H12O6完全氧化时产生的热量为:0.556ml×2800kJ/ml=1557kJ 答:100g葡萄糖在人体组织中完全氧化时产生的热量为1557kJ。
【例题2】焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为①C(s)+H2O(g)=CO(g)+H2(g) △H1=+131.5 kJ/ml②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+205.9 kJ/ml试计算CH4(g)=C(s)+2H2(g)的△H
例3:[2019年全国II卷]已知:
(g)+ I2(g)=
ΔH3=___________kJ·ml −1。
(g)+H2(g) ΔH1=+100.3 kJ·ml −1 ①
H2(g)+ I2(g)=2HI(g)
ΔH2=﹣11.0 kJ·ml −1 ②
(g)+2HI(g) ③
解析:根据盖斯定律,反应①+②可得反应③,则△H3=△H1+△H2=100.3kJ·ml-1+(-11.0kJ·ml-1)=+89.3kJ·ml-1。
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) 的ΔH=_________ kJ·ml-1。
例4:[2019年全国III卷]Deacn直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+
Cl2(g) ΔH1=+83 kJ·ml-1
O2(g)=CuO(s)+
Cl2(g) ΔH2=-20 kJ·ml-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·ml-1
解析:由盖斯定律可得,4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=2△H3+2△H1+2△H1=(-121kJ·ml-1)×2+(-20kJ·ml-1)×2+(83 kJ . ml-1)×2=-116kJ·ml-1
例5:[2018年全国II卷]CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g)
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·ml−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·ml−1
O2(g)=CO(g) ΔH=-111 kJ·ml−1
该催化重整反应的ΔH=______ kJ·ml−1
解析:①C(s)+2H2(g)=CH4(g) △H=-75kJ/ml,②C(s)+O2(g)=CO2(g) △H=-394kJ/ml,③C(s)+ O2(g)=CO(g) △H=-111kJ/ml,根据盖斯定律计算:③×2-①-②,得CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247kJ/ml。
(三)利用燃烧热求反应热
例题:乙醇的燃烧热为△H=-1366.8kJ·ml,则25℃,101kPa时1kg乙醇完全燃烧放出的热量为 kJ
解:由题意可得出关系式为:C2H6O--------1366.8
(四)利用化学键的键能求反应热:
三、【例题分析】
例题1:下表中的数据表示破坏1ml化学键需消耗的能量(即键能,单位为kJ·ml-1)热化学方程式:H2(g)+Cl2(g)=2HCl(g) △H=-183kJ·ml-1,则Cl2的键能为 kJ/ml。
解:△H=-183kJ·ml-1=(436kJ/ml+y)-431kJ/ml×2
计算可得y=243kJ/ml
例题2:利用下图所给信息,计算工业上合成氨反应的反应热∆H= kJ/ml
△H=508-600=-92kJ/ml
(一)如果热化学方程式中化学计量数加倍,ΔH也要加倍,再通过吸放热反应类型比较ΔH大小
(二)同一反应中反应物或生成物状态不同时,要考虑A(g) A(l) A(s);或者从物质三种状态自身所具有的能量比较:E(g)>E(l)>E(s),可知反应热大小也不相同
(三)对于晶体类型不同,产物相同的反应,其反应热也不同。例如:C(石墨, s)+O2(g)=CO2(g) ΔH=—akJ/ml ①,C(金刚石, s)+O2(g)=CO2(g) ΔH=—bkJ/ml ②,由①②推出C(石墨, s)=C(金刚石, s) ΔH=(b—a)kJ/ml,又因为石墨的所具有的能量<金刚石所具有的能量,所以 ΔH>0,即b—a>0,所以b>a
注:在比较反应热大小时,要注意比较的是放出热量的大小还是ΔH的大小,当反应为放热反应时,二者的比较结果正好相反
(四)根据反应进行的程度比较反应热的大小
1、其他条件相同时,燃烧越充分,放出热量越多,ΔH越小
2、对于可逆反应,由于反应物不可能完全转化为生成物,所以实际放出(或吸收)的热量小于相应的热化学方程式中的ΔH的绝对值
(五)中和反应中反应热的大小
1、浓硫酸和氢氧化钠固体反应生成1ml水时,放出的热量一定大于57.3kJ(浓硫酸稀释和氢氧化钠固体溶解时都会放出热量)
2、醋酸和氢氧化钠溶液反应生成1ml水时,放出的热量一定小于57.3kJ(醋酸电离会吸热)
3、稀硫酸和氢氧化钡溶液反应生成1ml水时,放出的热量一定大于57.3kJ(SO42-和Ba2+反应生成的BaSO4沉淀会放热)
高中化学人教版 (2019)选择性必修1第二节 反应热的计算评优课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算评优课ppt课件,共46页。PPT课件主要包含了知识梳理,正误判断,问题导学,核心突破,试题调研,完成课时作业四,课后作业等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 反应热的计算优秀课件ppt: 这是一份人教版 (2019)选择性必修1第二节 反应热的计算优秀课件ppt
高中化学苏教版选修4 化学反应原理第一单元 化学反应中的热效应课前预习课件ppt: 这是一份高中化学苏教版选修4 化学反应原理第一单元 化学反应中的热效应课前预习课件ppt,共13页。PPT课件主要包含了molH2O,mol,温度计,环形玻璃搅拌棒,保温杯,盐酸温度t1℃,中和反应的反应热,ΔH-,KJ·mol-1,盖斯定律等内容,欢迎下载使用。













