






2021学年第二节 化学平衡集体备课ppt课件
展开
这是一份2021学年第二节 化学平衡集体备课ppt课件,共35页。PPT课件主要包含了化学平衡状态,N2+3H2,NH3,二建立,用含量判断,化学平衡常数,一定义,二表达式,四说明,五应用等内容,欢迎下载使用。
(一)研究对象:可逆反应
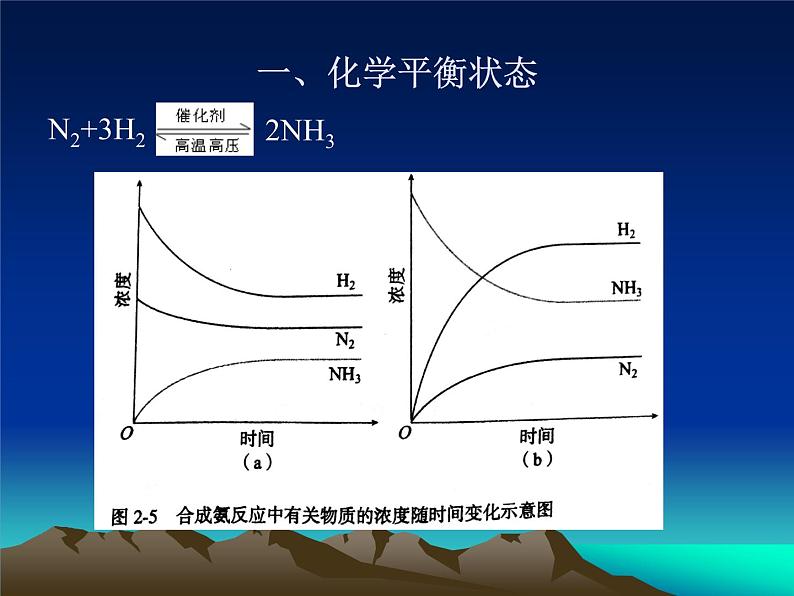
(三)定义:一定条件下的可逆反应,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
(四)特点——逆、等、动、定、变
1、逆:研究对象是可逆反应
2、等:平衡时,同一物质的正逆反应速率相等即v正=v逆
3、动:化学平衡是动态平衡,即达平衡时正逆反应仍 在进行,只不过同一物质的v正=v逆
4、定:在平衡体系的混合物中,各组分的含量(物质 的量、质量、浓度、质量百分数、物质的量百 分数、体积百分数等)保持一定
注:化学平衡状态是在一定条件下可逆反应所能达到 的最大程度,即该反应进行的限度。化学反应的 限度决定了反应物在该条件下的最大转化率
(5)变:任何化学平衡状态均是暂时的,相对的,有条 件的,与达平衡的过程无关(即化学平衡状态 既可以从正反应方向开始达平衡,也可以从逆 反应方向开始达平衡,还可以从正逆两个方向 开始达平衡)当外界条件变化时,原来的化学 平衡也会发生相应的改变,直至在新的条件下 建立新的平衡状态
(五)判断达化学平衡的标志
1、用速率判断:方法:先找出正、逆反应速率,再看物质
若同一物质,则正逆速率相等
例:一定温度下,可逆反应A(g)+3B(g) 2C(g)未达到平衡的是()A. C的生成速率与C的分解速率相等B. 单位时间内生成n ml A的同时消耗4n ml BC. A、B、C的浓度不再变化D. C的百分含量达到最大值
若不同物质,则速率之比=系数之比
(1)平衡时,各组分的物质的量、质量、浓度、体积、物质的量分数、质量分数、体积分数、转化率、产率都不变
(2)若反应中有颜色变化,颜色不变时可认为达平衡
(3)绝热的恒容反应体系中温度或压强保持不变,说明已达平衡
(4)有固态、液态、气态不同状态物质参与的反应,混合气体的总质量不变,或混合气体的密度不变,都可以判断达平衡
(5)对于反应前后气态物质前面的总系数发生改变的反应,混合气体的总物质的量不变,或混合气体的摩尔质量不变,或混合气体的压强不变都可以用来判断达平衡
例1:可逆反应2NO2(g) 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )①单位时间内生成n ml O2的同时生成2n ml NO2②单位时间内生成n ml O2的同时生成2n ml NO③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A.①④⑥⑦ B.②③⑤⑦C.①③④⑤ D.全部
例2:一定温度下,在一容积不变的密闭容器中发生可逆反应2X(g) Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )A.混合气体的密度不再变化B.反应容器中Y的质量分数不变C.X的分解速率与Y的消耗速率相等D.单位时间内生成1 ml Y的同时生成2 ml X
例3:一定温度下,在容积恒定的密闭容器中进行如下反应:A(s)+2B(g) C(g)+D(g)。当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )①混合气体的总物质的量②B的物质的量浓度③容器内气体的压强④混合气体的密度
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用符号K表示
对于一般的可逆反应:mA(g)+nB(g)
pC(g)+qD(g),
K只与温度有关,与反应物或生成物的浓度、压强、催化剂无关
(1)表达式的浓度必须是平衡时的浓度,系数决定幂次
(2)有固体或纯液体(H2O)参与的反应,其浓度视为“常数”不计入表达式中
(3)K有单位,但一般不写
(4)K表示某一具体反应的平衡常数,当反应方向改变或系数改变时,K也相应发生改变
(5)对于同一可逆反应,正反应的平衡常数等于逆反应的平衡 常数的倒数,即
(五)应用:
1、判断反应进行的程度
K增大→产物所占的比例增大→正反应进行程度增大→反应进行越完全→反应物转化率增大
一般来说,当K>105时,反应基本完全(不可逆反应); 当KK时,反应要达平衡→生成物的浓度减小,反应物的浓度升高→正反应速率v(逆),平衡向正反应向移动;
若v(正)b+c时,A的转化率增大;
a
相关课件
这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡优质ppt课件,共29页。PPT课件主要包含了学习目标,一可逆反应,二化学平衡状态,四化学平衡常数等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第二节 化学平衡优秀课件ppt,共15页。PPT课件主要包含了化学平衡常数,催化剂,课堂练习,平衡转化率,课堂小结等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡获奖ppt课件,共20页。PPT课件主要包含了可逆反应,可逆反应及其特点,化学平衡状态,条件改变平衡移动,动态平衡,v正=v逆,可逆反应研究对象,课堂练习等内容,欢迎下载使用。










