






高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学演示课件ppt
展开这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学演示课件ppt,共33页。PPT课件主要包含了一盐的分类,按组成分,盐类的水解,溶液呈酸性或碱性,4试剂的贮存,CO32-+H2O,泡沫灭火器,炸油条时加入等内容,欢迎下载使用。
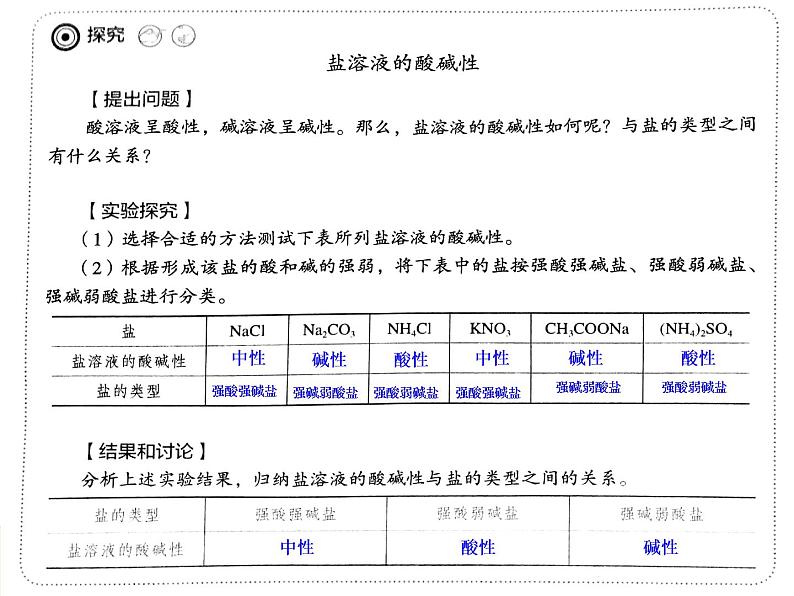
电离时生成的阳离子是金属离子(或铵根),阴离子为酸根离子的盐。例:Na2CO3
电离时生成的阳离子除金属离子(或铵根)外还有氢离子,阴离子为酸根离子的盐。例:NaHCO3
电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或NH4+)的盐。例:Cu2(OH)2CO3
易溶盐(NaCl);微溶盐(CaSO4);难溶盐(BaCO3)
3、按形成盐的酸碱的强弱不同:
强酸强碱盐(KNO3)
强酸弱碱盐(NH4Cl)
强碱弱酸盐(NaF)
弱酸弱碱盐(CH3COONH4)
Na+、Cl-、H+、OH-
NH4+、Cl-、H+、OH-
Na+、CH3COO-、H+、OH-
能(H2O、NH3•H2O)
能(H2O、CH3COOH)
c(H+)=c(OH-)
c(H+)>c(OH-)
c(H+)
在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解
(1)极其微弱,为可逆反应,存在水解平衡
(2)是中和反应的逆反应,水解反应是吸热反应
有弱就水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性
例:CH3COONa、NaCl Na2CO3、CH3COONH4 NH4Cl、Na2S、K2SO4
注:(1)组成盐的酸越弱,水解程度越大。 例如:水解程度:Na2CO3 >CH3COONa, 因为酸性:H2CO3
(3)弱酸酸式盐的酸碱性,看电离与水解程度大小HCO3-、HPO42-、HS- 以水解为主→显碱性 HSO3-、H2PO4- 以电离为主→显酸性
例如:0.1ml/L的Na2CO3 >0.1ml/L的NaHCO3
5、盐类水解方程式的书写
①必须写“ ”
③H2CO3、H2SO3等不拆开
④多元弱酸阴离子分步水解,分步书写,以第一步为主;多元弱碱阳离子水解方程式一步写完
⑤遵守质量守恒、电荷守恒、客观事实
(2)书写模式: 盐的离子+ H2O 弱酸(或弱碱)+OH-(或H+)
例:CH3COONa:
CH3COO-+H2O CH3COOH+OH-
NH4++H2O NH3·H2O+H+
CO32-+H2O HCO3-+OH-(主要)
HCO3-+H2O H2CO3+OH-(次要)
Fe3++3H2O Fe(OH)3+3H+
PO43-+H2O HPO42-+OH-(主要)
HPO42-+H2O H2PO4-+OH- (次要)
H2PO4-+H2O H3PO4+OH- (次要)
3、双水解——阴阳离子都水解
(1)非彻底型:用“ ”连接
例:CH3COONH4:
CH3COO-+ NH4++H2O
CH3COOH+NH3·H2O
NH4++F-+H2O HF+NH3·H2O
CN-+NH4++H2O HCN+NH3·H2O
(2)彻底型:用“=”连接。特点:有“↑”或“↓”生成,能同时离开体系
2Al3++ 3S2-+6H2O=2Al(OH)3↓+3H2S↑
Fe2(CO3)3:
2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
3AlO2-+Al3++6H2O=4Al(OH)3↓
二、影响盐类水解的主要因素
越弱越水解,越水解其酸(或碱)性越强
向甲、乙两支试管中分别加入 5mL0.01ml l/ FeCl3溶液,加热甲试管一段时间,测定两支试管中溶液的pH,对比观察溶液颜色的变化
甲试管中溶液的颜色明显加深,溶液的pH减小
水解过程是吸热的,加热使水解平衡向正反应方向移动,生成更多的Fe(OH),颜色加深,c(H)增大,pH减小。
向甲、乙两支试管中分别加入10mL 0.01ml/ FeCl3溶液,向甲试管中加入少量FeCl3晶体,振荡、静置,对比观察溶液颜色的变化。
甲试管中溶液的颜色加深
增大氯化铁浓度,水解平衡向正反应方向移动,溶液的颜色加深。
向甲、乙两支试管中分别加入10mL0.01ml/ FeCl3溶液,向甲试管中加入少量浓盐酸,向乙试管中加入等体积的蒸馏水,振荡、静置,对比观察溶液颜色的变化。
甲试管中溶液颜色变浅。
增大氯化氢的浓度,水解平衡向逆反应方向移动, 溶液的颜色变浅。
答:在其他条件相同时,升高温度或增大反应物的浓度,FeCl3的水解平衡向正反应方向移动;在其他条件相同时,增大生成物的浓度, FeCl3的水解平衡向逆反应方向移动
加水稀释 →向右移动→水解程度大→酸(或碱)性减弱
盐的浓度越高→向右移动→水解程度小→酸(或碱)性增强
(3)同离子效应:加酸或碱抑制或促进水解
小结:越弱越水解,越热越水解,越稀越水解,加酸或碱抑制或促进水解
(三)举例:以CH3COONa溶液为例分析外因对盐类水解平衡的影响情况:CH3COO-+ H2O
CH3COOH+OH-
(一)在化学实验中的应用
1、判断溶液的酸碱性确定pH范围
例:同浓度的下列溶液,按照pH由大到小的顺序排列:CH3COOH、NaHCO3、NH4Cl、KNO3、KHSO4、(NH4)2SO4、NaOH、H2SO4、Na2CO3、CH3COONaBa(OH)2
答案:Ba(OH)2> NaOH> Na2CO3> NaHCO3> CH3COONa> KNO3> NH4Cl> (NH4)2SO4>CH3COOH> KHSO4> H2SO4
2、盐溶液中微粒种类的判断
例:指出Na2CO3溶液和KHS溶液中的粒子
Na2CO3溶液:Na+、CO32-、HCO3-、OH-、H+、 H2O、H2CO3
KHS溶液:K+、HS-、S2-、H+、OH-、H2S、H2O
3、配制和贮存易水解的盐溶液
(1)配制强酸弱碱盐溶液时,加强酸抑制水解
例:配制FeCl3、AlCl3溶液时,加HCl抑制水解 配制CuSO4溶液时,加H2SO4抑制水解
(2)配制强碱弱酸盐溶液时,加强碱抑制水解
例:配制Na2S、Na2CO3溶液时,加NaOH抑制 水解,且保存在橡胶塞的玻璃瓶中
(3)配制Al2S3只能在干态条件下把铝粉和硫粉的混 合物加热,不能在水溶液中得到
Na2SiO3溶液的试剂瓶不能用磨口玻璃塞
NH4F溶液不能用玻璃瓶盛放
4、判断盐溶液蒸干产物
(1)不水解不分解的盐(如NaCl、K2SO4)
水解生成不挥发性酸的盐(如Al2(SO4)3)
(2)水解生成挥发性酸的盐(CuCl2、Fe(NO3)3、MgBr2)
(3)较低温度下受热分解的盐(NaHCO3)
如:FeSO4→Fe2(SO4)3, Na2SO3→Na2SO4
(5)其他:NaClO溶液
5、活泼金属与强酸弱碱盐反应产生氢气:
例:Mg与NH4Cl(或FeCl3、AlCl3、CuCl2)反应,产生H2
Mg+2NH4Cl=MgCl2+H2↑+2NH3↑
Al3+、Fe3+、Cu2+与CO32-、HCO3-、S2-、HS-、AlO2-生成气体或沉淀的双水解不能共存
饱和FeCl3溶液滴入沸水中因水解得到Fe(OH)3胶体。
Fe(OH)3(胶体)+3HCl
(1)KNO3(Fe(NO3)3)
促进Fe(NO3)3水解→除去Fe3+
(2)MgCl2(FeCl3):
促进Fe3+水解→Fe(OH)3→除杂
9、酸碱中和时指示剂的选择
强碱滴定弱酸时(生成的盐溶液水解呈碱性)常用酚酞做指示剂
强酸滴定弱碱时(生成的盐溶液水解呈酸性)常用甲基橙做指示剂
(二)在日常生活中的应用
1、去污:热的纯碱去污能力强。
HCO3-+OH- 温度升高→促进水解→c(OH-)升高
注: CO2使油条变得松脆可口
明矾净水:Al3++3H2O
Al(OH)3+3H+
Fe(OH)3+3H+
Al(OH)3和Fe(OH)3都具有吸附性
主要成分是CaCO3和Mg(OH)2,不会生成MgCO3,因为MgCO3微溶,受热水解生成更难溶的Mg(OH)2
(三)在工农业生产中的应用
(1)长期施用(NH4)2SO4的土壤因NH4+水解,使土壤酸性增强:
NH3·H2O+H+
(2)铵态氮肥与草木灰(K2CO3)不能混合施用:
NH4++OH-=NH3·H2O= NH3↑+H2O
(3)普钙(或过磷酸钙)(Ca(H2PO4)2)与草木灰不能混合施用:
2、焊接时用NH4Cl溶液除锈:利用其水解后溶液显酸 性,溶解铁锈
TiCl4+(x+2)H2O(过量)
TiO2·xH2O↓+4HCl
用TiCl4制备TiO2:
影响因素:水解平衡常数只受温度的影响,因水解是吸热反应,故水解平衡常数随温度的升高而增大
相关课件
这是一份化学选择性必修1第三节 盐类的水解集体备课课件ppt,共9页。PPT课件主要包含了实验探究,现象与结论,理论探究,一·盐类的水解,①常见可水解阴离子,②常见可水解的阳离子,归纳整理,强化训练,课堂巩固练习,第三节盐类的水解等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解集体备课课件ppt,共48页。PPT课件主要包含了第一课时,那么盐呢,H2O等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第三节 盐类的水解优秀课件ppt,共21页。PPT课件主要包含了加相应的酸或碱,抑制Fe2+的水解,防止Fe2+被氧化,①加MgOH2,②加MgO,③加MgCO3,臭氧双氧水等,其他应用等内容,欢迎下载使用。













