
















化学九年级下册课题 2 金属的化学性质集体备课ppt课件
展开第八单元 金属和金属材料
课题2 金属的化学性质
设计说明 本课题分三部分,第一部分为金属与氧气的反应。学生在前一阶段的学习中了解了镁条、铁丝等在空气(或氧气)中反应的实验,基于学生已有的知识基础,可以通过归纳实验事实的方法,得出大多数金属能与氧气反应,但反应的难易和剧烈程度不同,由此也可以在一定意义上反映金属的活泼程度,如镁、铝比较活泼,铁、铜次之,金最不活泼。[来源:Zxxk.Com][ 第二部分为金属与盐酸、稀硫酸的反应。该部分知识可以通过探究活动,采用“实验—讨论”的探究模式,通过对实验事实的分析,层层诱导,让学生自己找出哪些金属能与盐酸、稀硫酸反应,哪些金属不能反应,从而归纳得出镁、锌、铁的金属活动性比铜的强。另外,学生自己归纳置换反应的特点,得出置换反应的概念。 第三部分为金属活动性顺序。对于该部分内容,可以设计一个探究活动,同样采用“实验—讨论”的探究模式,并通过对某些金属的活动性的比较,引出金属活动性顺序。同时,教师通过精讲点拨,指出金属活动性顺序有许多重要的应用,并介绍基于金属活动性顺序的一些判断,教学中可以通过练习,使学生学会应用置换反应和金属活动性顺序解释一些与日常生活有关的化学问题。 教学目标 【知识与技能】 1.知道镁、铝、铁、铜等常见金属与氧气的反应。 2.初步认识常见金属与盐酸、稀硫酸的反应。能用金属和酸反应的规律解释一些与日常生活有关的化学问题。 3.初步认识常见金属与金属化合物溶液的置换反应,能用置换反应解释一些与日常生活有关的化学问题。 4.能用金属活动性顺序对有关的置换反应进行简单地判断,并能利用金属活动性顺序解释一些与日常生活有关的化学问题。 【过程与方法】 1.通过金属与盐酸、稀硫酸的反应,学习利用控制变量法进行科学探究。 2.能根据金属与盐酸、稀硫酸反应的剧烈程度判断金属活动性顺序。 3.通过探究金属与金属化合物溶液的反应判断金属活动性顺序。 【情感、态度与价值观】 在实验操作中,体验获得科学方法的过程,养成实事求是的科学精神和严谨的科学态度,激发学习化学的兴趣。
重点难点 教学重点 1.金属与氧气的反应,金属与盐酸、稀硫酸的反应。 2.金属与金属化合物溶液的反应,金属活动性顺序及其应用。 教学难点 金属活动性顺序的应用。 教学方法 探究法:通过学生的探究实验,引导学生学会正确推理以及能概括出金属活动性顺序。 归纳法:通过金属与酸反应的化学方程式的比较,归纳出置换反应的特点,理解并掌握置换反应。 控制变量法:在做金属与酸反应的实验中,要注意控制酸的浓稀、金属的表面积、温度、酸的种类及酸溶液的质量等因素。 教具、学具 1.计算机多媒体教学系统、CAI课件等。 2.仪器:药匙、镊子、试管、试管架等。 3.药品:稀盐酸、稀硫酸、镁片、锌片、铁片、铜片、铝片、硝酸银溶液、硫酸铜溶液、硫酸锌溶液等。 授课时数 2课时 第1课时 金属的化学性质 教学过程 导入新课 【教师提问】不法商贩用铜锌合金冒充黄金欺骗消费者,你能用简单的方法去拆穿他们的骗局吗? 【学生回答】用测密度(两者的密度不同)、硬度、测熔点(熔点不同)等方法。 【教师讲解】这些方法都是一些物理方法,在现场不容易实现,我们可以用一些化学方法来鉴别黄金的真伪。学完本课,你就会用化学方法鉴别黄金的真伪了。 讲授新课 一、金属与氧气的反应 【教师讲解】回忆一下我们曾经学过的金属与氧气的反应,写出反应的化学方程式。 【学生书写】老师巡视,指导学生书写化学方程式。 2Hg+O22HgO 3Fe+2O2 Fe3O4 2Mg+O22MgO 【教师点拨】引导学生描述曾经学过的金属与氧气反应的现象,比较这几种金属的活动性。 【学生回答】汞、铁、镁与氧气反应的现象。
【归纳总结】镁比铁活泼,铁比汞活泼。 【教师提问】所有的金属都可以和氧气发生反应吗?用生活中的例子来 说明。 【学生回答】黄金饰品不变色,说明金不和氧气反应。(古代用金、银作为货币,说明金、银一般不和氧气发生反应。) 【教师提问】“真金不怕火炼”说明了什么?为什么暖气片上要刷“银粉”?“银粉”是银吗? 【学生回答】即使在很高的温度下,金也不和氧气发生反应。 铝在空气中和氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化,所以暖气片上涂的“银粉”,其成分是铝,并不是银。 【学生讨论】组织学生讨论金属与氧气反应的规律,金属越活泼,越容易和氧气发生反应。 【得出结论】大多数的金属能够和氧气发生反应,但是反应的难易和剧烈程度不同。 【教师讲解】铝在常温下能和氧气发生反应,其表面生成一层致密的氧化膜,阻止铝进一步氧化,金在高温下也不和氧气发生反应。几种常见金属与氧气反应的化学方程式如下: 2Mg+O22MgO 4Al+3O22Al2O3 3Fe+2O2Fe3O4 2Cu+O22CuO 二、金属与盐酸、稀硫酸的反应 【教师提问】我们已经学过锌和稀硫酸的反应、镁和盐酸的反应,那么其他的金属可以和稀硫酸反应吗?金属与盐酸或稀硫酸是否反应以及反应的剧烈程度,也可反映出金属的活泼程度。下面,我们就通过实验来比较镁、锌、铁、铜的活动性。 【实验探究】学生猜想并设计实验,探究镁、锌、铁、铜分别和稀盐酸、稀硫酸的反应,观察现象。实验结束后,写出反应的化学方程式。 【学生实验】将学生分成四组,两组做实验A,另两组做实验B。 实验A:在四支试管中分别放入打磨光洁的镁条、锌粒、铁片、铜片,各加入约5 mL稀盐酸,观察现象,比较反应的剧烈程度;用燃着的木条放在试管口,观察并记录实验现象。 实验B:用稀硫酸代替稀盐酸进行上述实验,并比较发生的现象。 【教师提问】 请两位同学在黑板上书写上述反应的化学方程式,现象由学生口述。通过以上实验,你得出的结论是什么? 【学生回答】 实验A: Mg+2HClMgCl2+H2↑ Zn+2HClZnCl2+H2↑ Fe+2HClFeCl2+H2↑ 实验B: Mg+H2SO4MgSO4+H2↑ Zn+H2SO4ZnSO4+H2↑ Fe+H2SO4FeSO4+H2↑ (1)镁、锌、铁可与稀盐酸或稀硫酸反应生成氢气,铜不能与稀盐酸或稀硫酸反应。 (2)镁、锌、铁与稀盐酸或稀硫酸反应时的剧烈程度不同。镁反应最剧烈,其次是锌,然后是铁。 (3)与酸反应时,能生成氢气的金属活动性强;否则,就较弱。 (4)镁、锌、铁、铜的金属活动性依次减弱。 【教师提问】铝与稀盐酸和稀硫酸能否发生反应?为什么?如果能反应,请同学在黑板上写出化学方程式。 【学生回答】 2Al+6HCl2AlCl3+3H2↑ 2Al+3H2SO4Al2(SO4)3+3H2↑ 【教师展示】下面,是我们本节课探究时所发生的一些化学反应: 教师用投影展示下列反应的化学方程式 Mg+2HClMgCl2+H2↑ Zn+2HClZnCl2+H2↑ Fe+2HClFeCl2+H2↑ 2Al+6HCl2AlCl3+3H2↑ Mg+H2SO4MgSO4+H2↑ Zn+H2SO4ZnSO4+H2↑ Fe+H2SO4FeSO4+H2↑ 2Al+3H2SO4Al2(SO4)3+3H2↑ 【教师提问】请大家从反应物和生成物的物质类别如单质、化合物的角度,分析这些反应有什么特点?它们与我们学习过的化合反应和分解反应的特点是否相同? 【学生回答】这些反应的特点:由一种单质与一种化合物反应,生成另一种单质和另一种化合物。其特点不同于化合反应和分解反应。 【教师点拨】回答得很好。化学上,我们把具有这一特点的反应叫做置换 反应。 三、置换反应 【教师讲解】 1.置换反应的定义:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应。置换反应是化学反应的基本类型之一。 2.置换反应的特征:反应物和生成物都是一种单质和一种化合物。 3.置换反应的通式:A+BCB+AC。 4.置换反应的常见类型 (1)金属与酸的反应。如Zn+H2SO4ZnSO4+H2↑。 (2)金属与化合物溶液的反应。如Fe+CuSO4FeSO4+Cu。 (3)非金属与金属氧化物的反应。如2CuO+C2Cu+CO2↑。 注意:有单质和化合物参加的反应不一定是置换反应,如CH4+2O2CO2+2H2O;有单质和化合物生成的反应也不一定是置换反应,如CO+CuOCu+CO2。 【教师提问】请同学们比较一下化合反应、分解反应、置换反应。 【学生回答】
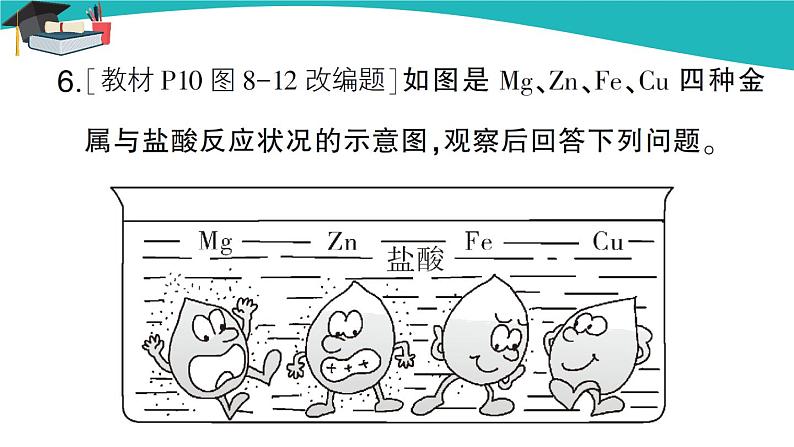
【教师提问】“假黄金”欺骗了很多人,其主要成分是铜锌合金。那么鉴别真假黄金的方法有哪些呢? 【学生回答】学生思考并回答: (1)取样品,放在酒精灯火焰上灼烧,变成黑色的是假黄金,不变色的是真黄金。 (2)把样品置于稀盐酸或稀硫酸中,有气泡产生的是假黄金,无现象的是真黄金。 课堂小结 通过本课的学习,我们了解了大多数金属能与氧气反应,不同金属的活动性不同。根据金属与酸的反应,可判断出金属活动性强弱。同时,我们还学习了一种新的反应类型——置换反应。 当堂达标 1.下列有关实验现象的描述正确的是( ) A.红磷在空气中燃烧,产生大量白色烟雾 B.铝片放入硫酸铜溶液一段时间后,其表面出现红色物质 C.铁丝在氧气中剧烈燃烧,火星四射,生成红色固体 D.镁条在空气中燃烧,产生白色火焰,生成黑色固体 答案:B 2.下列物质不能直接由金属和稀酸反应制取的是( ) A. AlCl3 B. ZnSO4 C. FeCl3 D. MgCl2 答案:C 3.对于金光闪闪的“假金元宝”(含铜与锌的合金),你认为下列鉴别方法不可行的是( ) A.用火烧 B.加入稀硫酸 C.看颜色 D.测密度 答案:C 4.将生铁放入足量的稀盐酸中充分反应后过滤,滤纸上有黑色固体,固体成分是( ) A.生铁 B.铁 C.碳 D.硫酸亚铁 答案:C 5.下列反应属于置换反应的是( ) A.Fe2O3+3CO2Fe+3CO2 B.CH4+2O2CO2+2H2O C.2Na+2H2O2NaOH+H2↑ D.Na2CO3+CaCl2CaCO3↓+2NaCl 答案:C 6.将等质量的镁和铁分别放入等质量、相同质量分数的稀盐酸中,产生氢气的质量与反应时间的关系如图所示,下列说法错误的是( ) A.反应结束后镁一定有剩余 B.反应消耗盐酸的总质量一定相等 C. O~t1 s时间段,产生氢气的质量镁比铁大 D. O~t2 s时间段,参加反应的镁的质量与铁相等 解析:根据镁、铁与稀盐酸反应的化学方程式可以推理: Mg+2HClMgCl2+H2↑,Fe+2HClFeCl2+H2↑ 24 73 2 56 73 2 1 2/24 1 2/56 由两种金属与稀盐酸反应的化学方程式可以看出,等质量的镁和铁完全反应后产生的氢气质量镁比铁大,而图像中镁与铁充分反应后最终产生的氢气质量相等,而产生等质量的氢气消耗的镁比铁少,所以反应结束后,镁一定有剩余,铁可能有剩余,A正确;由于最终产生氢气的质量相等,由化学方程式可以看出,产生等量的氢气,消耗盐酸的质量一定相等,B正确;由图像可以看出,O~t1 s时间段,镁产生氢气的质量比铁大,C正确;由图像可知,至t2 s时,镁、铁都已经充分反应,由于产生的氢气质量相等,由化学方程式可知参加反应的镁的质量比铁少,D错误。 答案:D 7.铝是目前最经济实用的金属材料之一。 (1)由铝制成的铝箔厚度仅为0.01 mm,广泛用于食品包装等。铝能制成铝箔,主要利用铝的性质是 。 (2)某小组同学将铝箔在酒精灯上加热,发现铝箔逐渐变软,中间有液体被外面的固体包裹住。由此可以推测氧化铝的熔点比金属铝 (填“高”或“低”)。 (3)将铝片和稀盐酸放在密闭容器中,用传感器探究反应容器内的温度随时间的变化如图所示,50 s时溶液中的溶质为 ;溶液温度升高的原因是 。 答案:(1)延展性 (2)高 (3)氯化铝和盐酸 铝与稀盐酸反应放热,使溶液温度升高 8.某同学利用如图所示装置测定铜锌合金中铜的质量分数。 (1)实验过程中须注入稀硫酸至不再产生气体,目的是 。 (2)计算该铜锌合金中铜的质量分数。 答案:(1)使合金中的锌完全反应 (2)解:由质量守恒定律,可知生成氢气的质量为380 g-378 g=2 g。 设80 g该铜锌合金中锌的质量为x。 Zn+H2SO4ZnSO4+H2↑ 65 2 x 2 g x=65 g 该铜锌合金中铜的质量分数为×100%=18.75%。 答:该铜锌合金中铜的质量分数为18.75%。 板书设计 第八单元 金属和金属材料 课题2 金属的化学性质 第1课时 金属的化学性质 一、金属与氧气的反应 大多数的金属能够与氧气发生反应,但反应的难易和剧烈程度不同。 二、金属与盐酸、稀硫酸的反应 镁、锌、铁可与盐酸或稀硫酸反应生成氢气,铜不能与盐酸或稀硫酸反应。 三、置换反应 1.定义:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应。置换反应是化学反应的基本类型之一。 2.特征:反应物和生成物都是一种单质和一种化合物。 3.通式:A+BCB+AC。 4.常见类型 |
人教版九年级下册课题 2 金属的化学性质获奖ppt课件: 这是一份人教版九年级下册课题 2 金属的化学性质获奖ppt课件,共23页。PPT课件主要包含了金属与氧气的反应,MnO2等内容,欢迎下载使用。
化学九年级下册课题 2 金属的化学性质公开课课件ppt: 这是一份化学九年级下册课题 2 金属的化学性质公开课课件ppt,共24页。PPT课件主要包含了导入新课,学习目标,讲授新课,镁与氧气反应,铝与氧气反应,铁与氧气反应,铜与氧气反应,活动探究,表面产生气泡非常快,表面产生气泡较快等内容,欢迎下载使用。
初中化学人教版九年级下册第八单元 金属和金属材料课题 2 金属的化学性质优质课ppt课件: 这是一份初中化学人教版九年级下册第八单元 金属和金属材料课题 2 金属的化学性质优质课ppt课件,文件包含第1课时金属与氧气酸的反应pptx、第1课时金属与氧气稀酸的反应docx、第1课时金属与氧气酸的反应docx、第1课时金属与氧气酸的反应学用docx、探究金属与盐酸稀硫酸的反应mp4等5份课件配套教学资源,其中PPT共25页, 欢迎下载使用。













