





人教版九年级下册第九单元 溶液综合与测试教学演示ppt课件
展开
这是一份人教版九年级下册第九单元 溶液综合与测试教学演示ppt课件,共32页。PPT课件主要包含了我们的复习目标,知识目标,能力目标,考点热点,溶液的特征,知识回顾,溶解时的热效应,被溶解的物质,能溶解其它物质的物质,H2SO4等内容,欢迎下载使用。
(1)通过对概念的复习,巩固同学们对概念的理解和掌握;
(2)使同学们对整单元的知识有一种系统的认知结构
(3) 加强对有关溶液稀释和配制以及溶质质量分数的计算的训练;
培养同学们分析能力、思维能力、推理、归纳等能力。
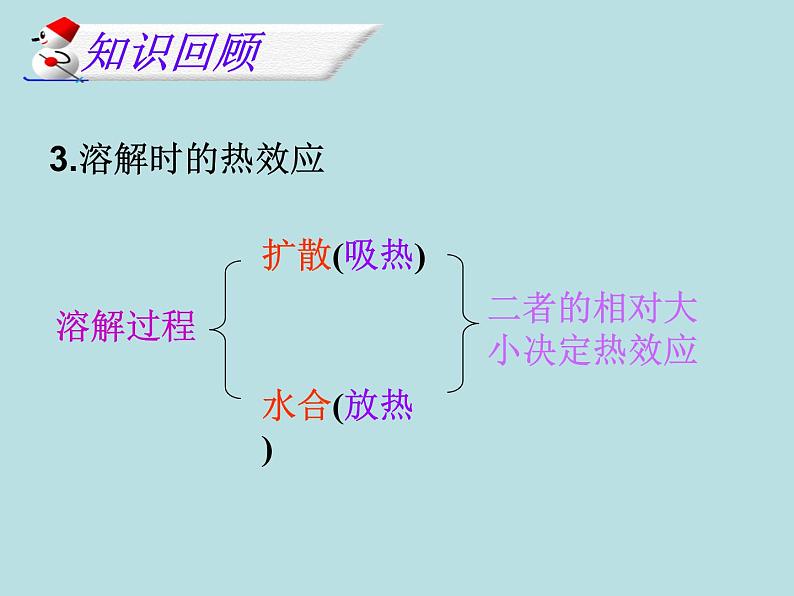
3 溶解度表或溶解度曲线表达的信息。
4 溶解过程中的热量变化,结晶的方法。
5 影响气体溶解度的因素。
1 溶液的概念,组成,特征.
6 配制一定质量分数的溶液.
7 溶质质量分数的有关计算。
2 饱和溶液和不饱和溶液的转化。
1、定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。
均一性:指溶液任一部分的组成和性质相同稳定性:在外界条件不变时,溶液稳定存在混合物:凡是溶液都属于混合物
(1)均一性 (2)稳定性
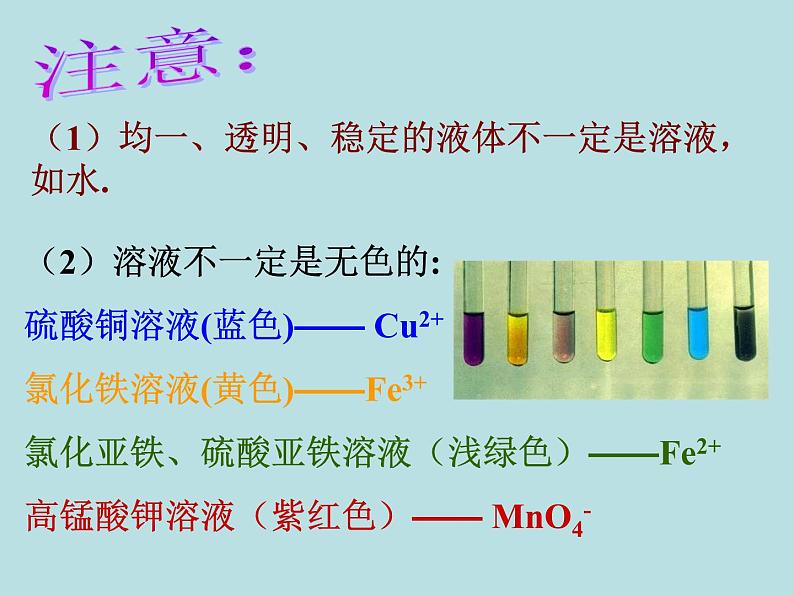
(1)均一、透明、稳定的液体不一定是溶液,如水.
(2)溶液不一定是无色的:硫酸铜溶液(蓝色)—— Cu2+氯化铁溶液(黄色)——Fe3+氯化亚铁、硫酸亚铁溶液(浅绿色)——Fe2+高锰酸钾溶液(紫红色)—— MnO4-
乳浊液: 小液滴分散(不溶解)到液体中形成的不均一不稳定的混合物。静置后两液体分层。 洗涤剂(如:洗洁精,肥皂等)具有乳化功能,使植物油分散成无数细小的液滴而随水一起流走。
( 3)溶液与乳浊液的不同
溶液、溶质与溶剂之间的量的关系1、m溶液 m质+m剂2、V溶液 V质+ V剂
5、溶液中溶质和溶剂的判断
根据名称一般固体或气体溶解于液体中,液体为溶剂两种液体组成溶液,量多的为溶剂有水时,水作为溶剂
3、指出下列溶液中的溶质: 稀硫酸______,澄清的石灰水_________ 稀盐酸______,白酒_______ 锌与稀盐酸完全反应得到的溶液______
1.下列常见物质中不属于溶液的是( )。 A.矿泉水 B.蒸馏水 C.盐水 D.汽水
2.下列关于溶液的说法错误的是( ) ①溶质只能是固体;②溶剂一定是水;③一种溶液只含有一种溶质;④溶液是无色的纯净物
A.①③④ B.①②③
C.②③④ D.①②③④
4.下列叙述正确的是( )A.一种或几种物质分散到另一物质里,形成均一的溶液.B.溶液都是无色、透明的、均一的、稳定的混合物.C、酒精和水以任意比例互相溶解时,均称为酒精的水溶液. D、植物油溶于汽油中形成不稳定的乳浊液.
5.如图所示,向试管中的水中加入下列某物质后,U形管中原来相平的红墨水液面出现了左高右低的水位差,则该物质可能是( ) A.苛性钠 B.生石灰 C.硝酸铵 D.活性炭
二、饱和溶液 不饱和溶液
讲溶液饱和或不饱和,一定要指明温度,溶剂质量和溶质。
注意:浓溶液和稀溶液只粗略地表示溶液里溶质含量的多少 。
在一定温度下,在一定量溶剂里,不能(还能)再溶解某种溶质的溶液,叫做该条件下这种溶质的饱和(不饱和)溶液。
一般规律:不饱和溶液 饱和溶液
降温、蒸发溶剂、加溶质
升温、蒸发溶剂、加溶质
特殊溶质:Ca(OH)2不饱和溶液 饱和溶液
6.下列做法一定能把饱和溶液变成不饱和溶液的是( ) A.升高温度 B.增加溶剂 C.增加溶质 D.降低温度7.判断一种溶液是否达到饱和状态的依据是( ) A.溶液中是否有不可溶解的固体存在 B.溶液能否继续溶解该种溶质 C.溶液颜色的深浅程度 D.测量溶液的密度
8。粗食盐的杂质主要是MgCl2,工业上常把粗盐 晶体粉碎后用饱和食盐水浸洗,再滤出食盐。对此,下列有关说法正确的是( ) A 浸洗前后,被浸洗的食盐中MgCl2的含量不变 B.浸洗前后,食盐水中NaCl的质量不变 C 浸洗用的饱和食盐水可以无限次地使用下去 D.粗盐粉碎的颗粒大小不影响浸洗后盐中MgCl2的含量 9。向一接近饱和的KNO3溶液中加KNO3固体下列图象中符合溶液中溶质质量变化规律的是( )
1.溶解性 一种物质溶解在另一种物质里的能力叫做溶解性,溶解性的大小跟溶质和溶剂的性质,温度和压强等有关。
2.固体的溶解度(S)(1)概念的理解:
抓四点: ①条件:在一定温度下 ②标准:100克溶剂 ③状态:饱和状态 ④单位:克
(4)表示方法①列表法②溶解度曲线
线: 溶解度随温度变化的情况
3、气体的溶解度 是指该气体在压强为101kPa,一定温度时,溶解在1体积水里达到饱和状态时的气体体积。
气体的溶解度与温度和压强有关,随温度升高而减小,随压强增大而增大 。
4.结晶①蒸发溶剂法: 适用于所有固态溶质,还常用于溶解度受温度影响较小的固体溶质。如蒸发海水获得食盐晶体。②冷却热饱和溶液法:常用于溶解度受温度影响较大的固体溶质.如冷却热的硝酸钾饱和溶液获得硝酸钾晶体.注意:①结晶后往往还需过滤来取得这些晶体. ②采用结晶的方法可以分离提纯两种固体溶质.如分离NaCl和KNO3的固体混合物 .
10、判断下列说法是否正确,如不正确,请说明理由。
(1)、向100g水中加入37g的NaCl刚好达到饱和状态,则NaCl的溶解度是37g。(2)200C时,把15g的NaOH完全溶解于100g水,则该温度下NaOH的溶解度是15g。(3) 200C时,向水中加入15g的NaOH刚好达到饱和状态,则该温度下NaOH溶解度是15g。(4) 200C时,把36gNaCl溶于100g水中刚好达到饱和状态,则该温度下NaCl的溶解度是36g。
11、在20℃时,NaCl的溶解度是36克.在20℃时,把20克NaCl投人到50克水中充 分溶解后,下列有关说法中,不正确的是( )A.制成了70克饱和溶液 B.制成了68克饱和溶液有18克NaCl发生溶解 D.还剩余2克固体NaCl(未溶解)
12、生活中的下列现象不能说明气体的溶解度随温度升高而减小的是( )A.烧开水时,沸腾前有气泡冒 出. B.喝下汽水时感到有气体冲到鼻腔.C.揭开啤酒瓶盖,有大量气泡冒出 . D.夏季黄昏,池塘里的鱼常游出水.
13、右图为A、B、C、三种物质的溶解度曲线。试回答:
(1)溶解度受温度影响最大的物质是 ,溶解度随温度升高而减少的物质是 。
(2)温度为 ℃,A、C两种物质的溶解度相等。
(3)t2℃时,三种物质的溶解度由大到小的顺序为 。
(4)t3℃时,A物质的溶解度为 。
(5)相同质量的三种饱和溶液,当温度从t4℃降到 t1℃时,溶液中析出晶体最多的物质是 ,没有晶体析出的是 。
(6)若A中混有少量的B物质,可以采用的 方法提纯。
五、溶液组成的表示---溶质的质量分数(ω)
(一).溶质的质量分数
(二)、溶质的质量分数与溶液体积、密度有关的换算
(三)、溶液的稀释与浓缩的计算
(四) 溶质的质量分数与化学方程式的综合计算。
14 、把某KNO3溶液作如下实验
问溶液A、B、C的溶质、溶剂、溶质质量分数的关系① 、溶质:mA mB mC② 、溶剂: mA mB mC③ 、溶质质量分数: a% b% c%
15.右图是硫酸厂刚生产一批的硫酸的标签上的部分内容,请阅读后完成:(1)该硫酸未开启前溶液的质量为 ;(2)该硫酸溶液的溶质的质量为 。
500mlX1.84g/cm3=920g
500mlX1.84g/cm3X98%=901.6g
16、右图是硫酸厂刚生产一批的硫酸的标签上的部分内容,请阅读后计算:实验室需要配制500g溶质质量分数为19.6%的稀硫酸,需要这种硫酸多少ml ?
品 名:硫酸体 积:500mL化学式:H2SO4相对分子质量:98密度:1.84 g/cm3质量分数:98%
设需要这种硫酸的体积为V500gX19.6%=VX1.84g/cm3X98%V=?
17 、为测定混有少量氯化钠的碳酸钠固体的质量分数,现进行如下实验:向盛有13.6克该混合物的烧杯中加入109.5克稀盐酸,恰好完全反应,反应过程用精密仪器测得烧杯和药品的质量和反应的数据记录如下:
求 (1)混合物中碳酸钠的质量分数? (2)反应后溶液中溶质的质量分数?
(三)一定溶质质量分数溶液的配制
固体: 托盘天平,药匙
液体: 量筒,胶头滴管
18、我校举行了部分学生化学实验操作竞赛,题目之一是“配制70克20%的氯化钠溶液” (1)需称取氯化钠的质量为 ____ 克。称量时A出现了右盘低的现象,接下来的操作应该是( ) A左边的平衡螺母向左调 B 右盘中减少砝码 C右边的平衡螺母向右调 D左盘中增加食盐 (2 ) 量取水时,如果按图B的方法读数,会使配得的溶质质量分数_______(选填“偏大”或“偏小”) (3 ) C中玻璃棒的作用是 _________________ (4 ) D中标签有不妥之处,请在方框中写出你认为合适的内容
相关课件
这是一份初中化学第九单元 溶液综合与测试集体备课ppt课件,共30页。PPT课件主要包含了溶液的特征,稳定性,溶液的组成,由溶质和溶剂组成,溶液的命名,碘的酒精溶液,不稳定静置分层,物理变化,化学变化,氢氧化钠等内容,欢迎下载使用。
这是一份初中化学人教版九年级下册第九单元 溶液综合与测试背景图课件ppt,共16页。PPT课件主要包含了复习目标,有关溶液的计算公式等内容,欢迎下载使用。
这是一份初中化学人教版九年级下册课题1 溶液的形成教课内容课件ppt,共32页。PPT课件主要包含了--关于溶液的认识,问题与思考,实验现象记录,非水物,乳化现象等内容,欢迎下载使用。










