





高考化学总复习13铁及其化合物课件PPT
展开
这是一份高考化学总复习13铁及其化合物课件PPT,共30页。PPT课件主要包含了知识梳理,铁的氧化物,+2+3,铁的氢氧化物,还原性,Fe3++2H2O,Cu2++2Fe2+,氧化性,2用NaOH溶液,助你进步等内容,欢迎下载使用。
考试说明1.了解铁及其重要化合物的主要性质及其应用。2.能鉴别溶液中的Fe2+、Fe3+。
考点一 铁的单质、氧化物和氢氧化物
考点三 铁及其化合物转化关系及应用
考点二 Fe2+与Fe3+的性质及检验
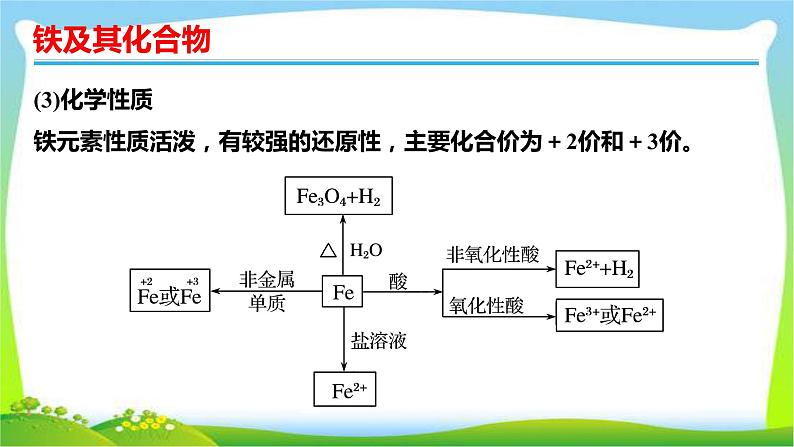
考点一 铁的单质、氧化物和氢氧化物1.铁(1)物理性质银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。(2)结构
(3)化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
按要求书写下列反应的方程式:①Fe与Cl2、S反应的化学方程式: ; 。②Fe与水蒸气的反应: 。
③与氧化性酸(如HNO3)的反应(写离子方程式)。Fe与过量稀HNO3的反应: 。Fe与少量稀HNO3的反应: 。④Fe与FeCl3溶液的反应(写离子方程式): 。
Fe+ +4H+===Fe3++NO↑+2H2O3Fe+2 +8H+===3Fe2++2NO↑+4H2OFe+2Fe3+===3Fe2+
Fe2O3+6H+===2Fe3++3H2O
FeO+2H+=== Fe2++H2O
4Fe(OH)2+O2+2H2O===4Fe(OH)3
Fe3++3OH-===Fe(OH)3↓
例1.正误判断,正确的打“√”,错误的打“×”(1)铁位于元素周期表中第四周期第ⅧB族( )(2)氧化铁能与酸反应,所以可用于制作红色染料( )(3)用铁制容器可以运输浓硝酸和浓硫酸( )(4)Fe2O3与NaOH溶液反应可制取Fe(OH)3( )(5)铁与过量的硫粉共热产物是Fe2S3( )(6)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2( )
例2.纯铁有较强的抗腐蚀能力,为什么日常生活中的铁制品容易生锈?
日常生活中的铁制品中的铁通常含有杂质碳,在潮湿的空气中易发生原电池反应(电化学腐蚀),生成氧化铁的水合物。
例3.通过化合反应能制取FeCl2、FeCl3、Fe(OH)2、Fe(OH)3吗?能制取的用化学方程式表示。
FeCl2、FeCl3和Fe(OH)3均能通过化合反应制取,而Fe(OH)2则不能。FeCl2:FeCl3+Fe===FeCl2FeCl3:①2Fe+3Cl2 2FeCl3②2FeCl2+Cl2===2FeCl3Fe(OH)3:4Fe(OH)2+O2+2H2O===4Fe(OH)3
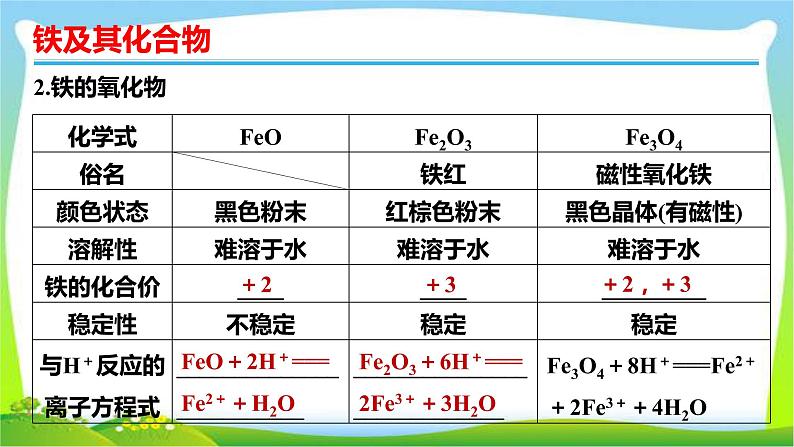
确定铁的氧化物组成的基本方法设铁的氧化物中铁元素与氧元素的质量比为m∶n,
若a∶b=1∶1,则铁的氧化物为FeO;若a∶b=2∶3,则铁的氧化物为Fe2O3;若a∶b=3∶4,则铁的氧化物是Fe3O4或FeO与Fe2O3按物质的量比1∶1的混合物或FeO、Fe2O3、Fe3O4的混合物(其中FeO、Fe2O3物质的量之比为1∶1,Fe3O4为任意值)。
防止Fe(OH)2氧化的方法(1)将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。(2)将盛有NaOH溶液的胶头滴管尖端插入试管的亚铁盐溶液底部,并慢慢挤出NaOH溶液。(3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。(4)在亚铁盐溶液上面加保护层,如苯、植物油等。(5)用Fe作阳极,石墨作阴极,电解NaOH溶液,利用新产生的Fe2+与OH-反应制取。
考点二 Fe2+与Fe3+的性质及检验1.亚铁盐(1)Fe2+的氧化性和还原性含有Fe2+的溶液呈浅绿色,Fe2+处于铁的中间价态,既有氧化性,又有还原性,其中以 为主,如:遇Br2、Cl2、H2O2、 (H+)等均表现为 。Fe2+的酸性溶液与H2O2反应的离子方程式:_____________________________________。
2Fe2++H2O2+2H+===
(2)可水解Fe(OH)2是弱碱,含Fe2+的盐(如硫酸亚铁)溶液呈酸性。配制硫酸亚铁溶液时常加少量 抑制Fe2+的水解,加少量 防止Fe2+被氧化。2.铁盐的性质及应用(1)氧化性:含有Fe3+的溶液呈棕黄色,Fe3+处于铁的高价态,遇Fe、Cu、HI、H2S等均表现为 。①Fe3+与 等具有较强还原性离子不能大量共存。②Fe3+可腐蚀印刷电路板上的铜箔,反应的离子方程式为__________________________。
S2-、I-、HS-、
2Fe3++Cu===
(2)易水解:Fe(OH)3是很弱的碱,且溶度积很小,因而Fe3+极易水解,只能存在于酸性较强的溶液中。①利用Fe3+易水解的性质,实验室可用FeCl3滴入沸水中制取氢氧化铁胶体,反应的化学方程式: 。②利用Fe3+易水解的性质,工业上常用调节pH方法除去溶液中的铁离子。③利用Fe3+易水解的性质,实验室配制氯化铁溶液,通常将氯化铁固体先溶于较浓的盐酸中,然后再稀释至所需浓度。④Fe3+与 等水解呈碱性的离子不能大量共存。
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
3.Fe2+、Fe3+的检验方法(1)用KSCN溶液和氯水
→无明显现象 溶液变红色―→Fe2+→溶液变红色―→Fe3+
→白色沉淀→灰绿色→红褐色→Fe2+→红褐色沉淀→Fe3+
(3)含Fe2+、Fe3+的混合溶液中Fe3+、Fe2+的检验
(4)Fe2+的特征检验方法溶液 产生蓝色沉淀,说明溶液中含有Fe2+,3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓
检验Fe2+和Fe3+时的注意事项(1)检验Fe2+时不能先加氯水后加KSCN溶液,也不能将加KSCN后的混合溶液加入到足量的新制氯水中(新制氯水能氧化SCN-)。(2)Fe3+、Fe2+、Cl-同时存在时不能用酸性KMnO4溶液检验Fe2+(Cl-能还原酸性KMnO4,有干扰)。(3)检验Fe2+、Fe3+的其他方法检验Fe3+也可用苯酚(C6H5OH),在FeCl3溶液中滴加苯酚,溶液显紫色。
4.含Fe2+、Fe3+的除杂问题
混合溶液中Fe3+、Fe2+的除去的常用方法(1)除去Mg2+中混有的Fe3+的方法向混合溶液中加入Mg、MgO、MgCO3、Mg(OH)2中之一,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀除去。(2)除去Cu2+中混有的Fe3+的方法向混合溶液中加入CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3中之一,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀而除去。
(3)除去Mg2+中混有的Fe2+的方法先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(1)的方法除去溶液中的Fe3+。(4)除去Cu2+中混有的Fe2+的方法先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(2)的方法除去溶液中的Fe3+。
考点三 铁及其化合物转化关系及应用“铁三角”的转化关系
完成下列变化的离子方程式,体会Fe2+与Fe3+转化条件。(1)将H2S气体通入FeCl3溶液中产生淡黄色沉淀: 。(2)将FeCl3溶液滴入KI-淀粉溶液,溶液变蓝: 。(3)FeCl3可溶解铁片: 。(4)FeSO4可使酸性KMnO4溶液褪色: 。(5)将FeCl2溶液滴入到HNO3溶液中,有无色气体放出: 。
H2S+2Fe3+===S↓+2Fe2++2H+2I-+2Fe3+===I2+2Fe2+2Fe3++Fe===3Fe2+5Fe2++ +8H+===5Fe3++Mn2++4H2O3Fe2++ +4H+===3Fe3++NO↑+2H2O
1.铁与稀硝酸反应产物中铁元素价态的判断方法(1)当HNO3过量时:反应原理:Fe+4HNO3===Fe(NO3)3+NO↑+2H2O,铁元素的存在形式为Fe3+,铁元素的价态为+3价。(2)当Fe过量时:铁被硝酸氧化为Fe3+,然后Fe3+被剩余的铁还原为Fe2+,也就是说最终得到亚铁盐,总方程式:3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O。
铁元素的存在形式为Fe2+和Fe3+,铁元素的价态为+2、+3价。(4)用数轴法表示,铁与硝酸的用量比与反应产物的关系:
2.铁与硫酸、硝酸的混酸反应顺序总结足量铁与稀硫酸、稀硝酸的混合溶液反应,则可利用离子反应分析,依次发生反应:Fe+ +4H+===Fe3++NO↑+2H2O、2Fe3++Fe===3Fe2+、Fe+2H+===Fe2++H2↑(若H+量不足,该反应不再发生)。
相关课件
这是一份2024年高考化学一轮总复习 第3单元 第2讲 铁及其化合物 课件,共60页。PPT课件主要包含了第2讲铁及其化合物,铁的化学性质,火星四射,水蒸气,FeO,Fe2O3,Fe3O4,磁性氧化铁,FeOH2,FeOH3等内容,欢迎下载使用。
这是一份人教版高考化学一轮总复习课时质量评价10铁及其化合物课件,共37页。
这是一份高中化学第一轮总复习3.8铁及其化合物完美课件PPT,共60页。








