


化学第一节 硫及其化合物课文课件ppt
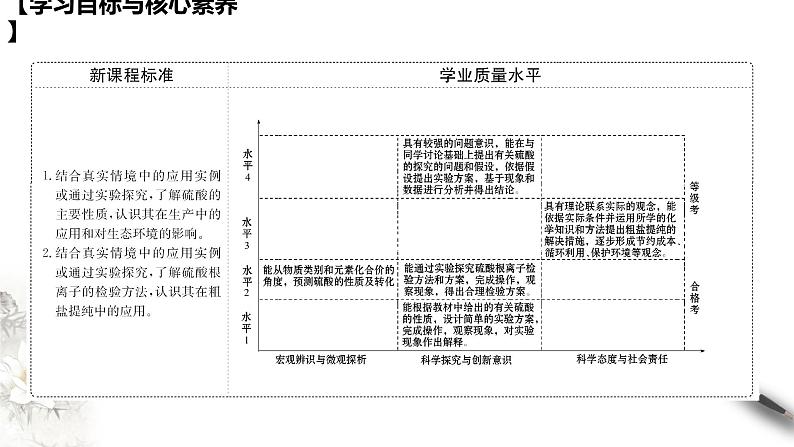
展开【学习目标与核心素养】
学习目标 1、了解浓硫酸的三大特性。 2、能运用氧化还原反应知识理解浓硫酸的氧化性。 3、认识硫酸在相关反应中体现的性质。
核心素养 1、通过对浓硫酸性质的学习,培养学生论据推理与模型认知的化学核心素养。 2、通过对化学实验的设计及操作的学习,培养学生科学探究与创新意识的化学核心素养。
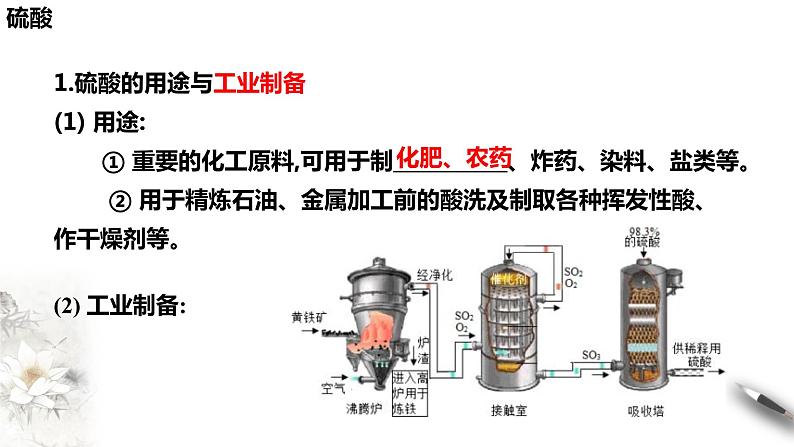
1.硫酸的用途与工业制备(1) 用途: ① 重要的化工原料,可用于制___________、炸药、染料、盐类等。 ② 用于精炼石油、金属加工前的酸洗及制取各种挥发性酸、作干燥剂等。
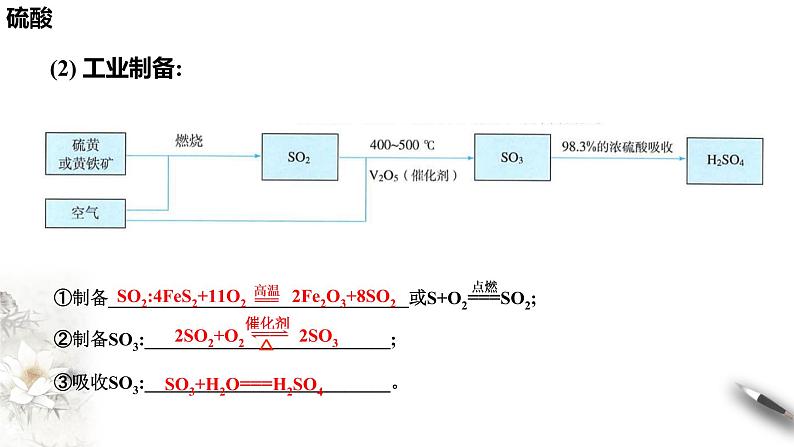
①制备_________________________________或S+O2===SO2;②制备SO3:___________________________;③吸收SO3:___________________________。
SO2:4FeS2+11O2 2Fe2O3+8SO2
2SO2+O2 2SO3
SO3+H2O===H2SO4
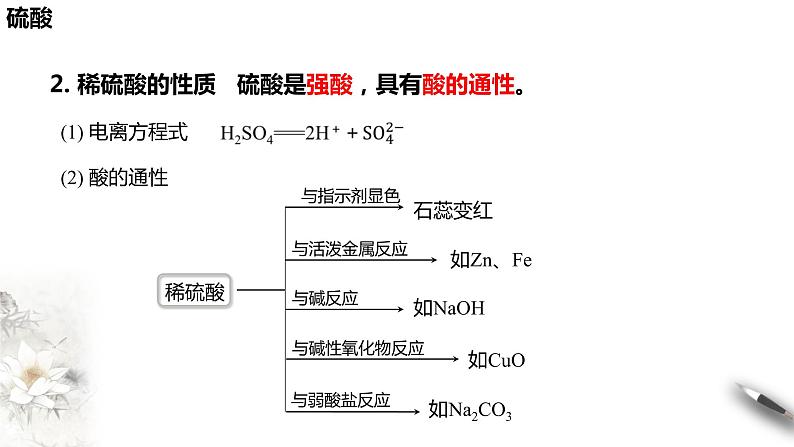
2. 稀硫酸的性质 硫酸是强酸,具有酸的通性。
1、 写出下列反应的离子方程式:(1)稀硫酸与活泼金属反应,如Zn:______________________。(2)稀硫酸与金属氧化物反应,如CuO:______________________。(3)稀硫酸与碱反应,如NaOH: ____________________________。(4)稀硫酸与部分盐反应,如Na2CO3: _______________________。
Zn+2H+===Zn2++H2↑
CuO+2H+===Cu2++H2O
OH-+H+===H2O
+2H+===CO2↑+H2O
(1) 吸水性:浓硫酸能吸收存在于周围环境中的水分,常用做干燥剂
(2) 脱水性:浓硫酸能将有机物中的氧、氢元素按水的组成比脱去
物质中不含有H2O,只含
1、浓硫酸能使蓝色胆矾变为白色,该过程体现了浓硫酸的脱水性还是吸水性?
d将a试管里的溶液慢慢倒入水中,溶液变为_____
a试管中铜丝表面__________________________
b试管中的品红溶液逐渐变为________
c试管中的紫色石蕊溶液逐渐变为________
逐渐变黑色,有气泡产生
问题:(1) 该方程式中,谁是氧化剂,谁是还原剂?(超链接) (2) 浓硫酸在这个反应中体现了什么性质? (3) 实验室用金属和酸反应制取氢气时,往往用稀硫酸、而不用浓硫酸,这是为什么?
Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
Cu + 2H2SO4(浓) = CuSO4+ SO2↑+ 2H2O
0 +6 +2 +4
还原剂 氧化剂 氧化产物 还原产物
若铜过量,硫酸能否完全反应?为什么?
2、浓硫酸能和金属反应,为什么可用铝罐车和铁罐车来运输浓硫酸?
常温下,浓硫酸让Fe、Al的钝化
b.还原产物一般是SO2
③ 与具有还原性的化合物反应,如H2S、HI、HBr、FeCl2等
1、浓硫酸具有A.强酸性,B.强氧化性,C.高沸点、难挥发性,D.脱水性,E.吸水性等性质。以下过程主要表现了浓硫酸的哪些性质?请将答案的字母分别填入括号中。(1) 用NaCl固体和浓硫酸在加热条件下制氯化氢气体( )(2)用磷矿物[主要成分是Ca3(PO4)2]和硫酸反应制磷酸( )(3)浓硫酸干燥H2、O2、Cl2、HCl和SO2等气体( )(4)常温下可以用铁或铝的容器贮存浓硫酸( )(5)胆矾放在盛浓硫酸的干燥器中变成白色粉末( )(6)不能用浓硫酸干燥HBr、HI和H2S等气体( )(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑( )
2.实验证明铜在低温下不能和氧气发生反应,也不能和稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取硫酸铜溶液的。铜屑在此状态下发生的一系列化学反应的方程式为____________________________________________。利用铜和浓硫酸在加热条件下也能制备硫酸铜溶液,其化学方程式为____________________________________。以上两种方法哪种好?______________,原因是______________________________________________________________________________________________________。
①制得相同质量的产品,第一种方法消耗的硫酸少,②第二种方法生成SO2,会造成大气污染,③第一种方法节约能源
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物示范课ppt课件: 这是一份高中化学人教版 (2019)必修 第二册<a href="/hx/tb_c4000033_t3/?tag_id=26" target="_blank">第一节 硫及其化合物示范课ppt课件</a>,共1页。
高中第一节 硫及其化合物教课ppt课件: 这是一份高中第一节 硫及其化合物教课ppt课件,共23页。PPT课件主要包含了硫酸的用途和制备,稀硫酸的化学性质,浓硫酸的特性,吸水性,Fe和Al,低温或常温,自主检测,Ag+,硫酸根离子的检验,观察有无白色沉淀产生等内容,欢迎下载使用。
高中实验活动2 铁及其化合物的性质备课课件ppt: 这是一份高中实验活动2 铁及其化合物的性质备课课件ppt,共20页。PPT课件主要包含了生产生活中的硫酸,工业制硫酸,思考与交流,浓硫酸的性质,浓硫酸的吸水性,用途可以作干燥剂,浓硫酸的脱水性,浓硫酸的强氧化性,逐渐变黑色,要点点拨等内容,欢迎下载使用。













