






必修 第一册第三章 铁 金属材料第一节 铁及其化合物教课内容ppt课件
展开1.结合实验探究,掌握Fe、Fe2+、Fe3+相互转化的途径。2.通过实验学会Fe2+、Fe3+的检验方法。3.了解铁盐、亚铁盐的主要性质及其在生产、生活中的应用。
身边的化学,发现问题
【思考】补/加铁食品中的铁元素是Fe2+或Fe3+ ?如何检验?
一、铁盐和亚铁盐的检验
1.实验探究(【实验3-2】观察实验,填写下表)
2.Fe2+的检验:Fe2+中先加入KSCN溶液,无明显现象,再加氯水,溶液变红色。【交流研讨】①鉴别Fe2+时, (填“能”或“不能”)先加氯水,再加KSCN溶液,原因是 。②如何证明FeSO4溶液是否变质?
无法排除铁离子的干扰
变质的FeSO4溶液中含有Fe3+。用洁净的试管取少量(1~2 mL)的样品溶液,向其中滴入KSCN溶液1~2滴,若溶液立即显红色证明含有Fe3+,即该溶液已变质。
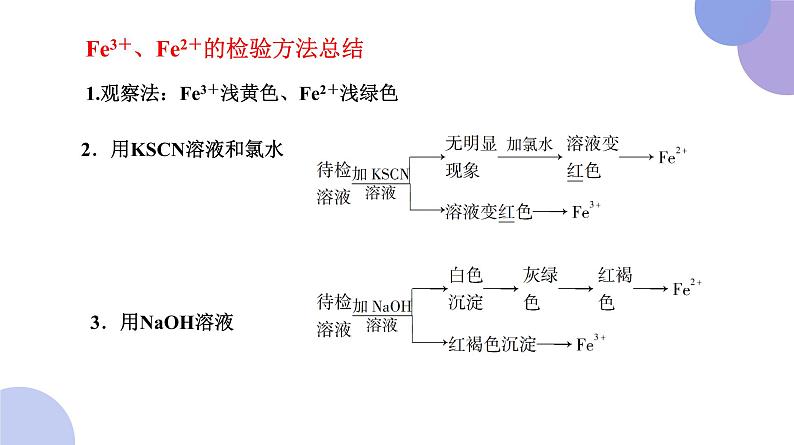
Fe3+、Fe2+的检验方法总结
1.观察法:Fe3+浅黄色、Fe2+浅绿色
2.用KSCN溶液和氯水
4.含Fe2+、Fe3+的混合溶液中Fe2+、Fe3+的检验
【例1】某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知SCN-、Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色,并结合已学的知识设计了如下实验:①将药片除去糖衣研细后溶解、过滤。②取滤液分别加入两支试管中,在一支试管中加入酸性KMnO4溶液,在另一支试管中加入KSCN溶液。请完成下列问题:(1)若滴入酸性KMnO4溶液后褪色,滴入KSCN溶液后不变红,结论是 。(2)若滴入酸性KMnO4溶液后不褪色,滴入KSCN溶液变红,结论是 。(3)若滴入酸性KMnO4溶液后褪色,滴入KSCN溶液变红,结论是 。(4) (填“能”或“不能”)将酸性KMnO4溶液和KSCN溶液滴入到同一支试管中进行验证,原因是 。
酸性KMnO4溶液呈紫红色,影响Fe3+的检验;KSCN具有还原性,影响Fe2+的检验
二、Fe2+、Fe3+的性质 (一)Fe3+的氧化性
含有Fe3+的溶液呈 ,Fe3+处于铁的高价态,遇Fe、Cu、HI、H2S等均表现 。(1)Fe3+与S2-、I-、HS-、SO32-等具有较强 的离子不能大量共存。(2)Fe3+可腐蚀印刷电路板上的铜箔,反应的离子方程式为 。
Cu+2Fe3+= Cu2++2Fe2+
【实验3-3】观察实验,填写下表:
加入铁粉,溶液变浅绿色,再加KSCN溶液,没有明显现象。
2Fe3++Fe=3Fe2+
2Fe2++Cl2=2Fe2++2Cl-
氧化性:Cl2>Fe3+>Fe2+
(二)Fe2+的氧化性和还原性含有Fe2+的溶液呈 色,Fe2+处于铁的中间价态,既有氧化性,又有还原性,其中以 为主,如遇Br2、Cl2、H2O2、NO3-(H+)等均表现 。Fe2+的酸性溶液与H2O2反应的离子方程式: 。
2Fe2++H2O2+2H+===2Fe3++2H2O。
三、Fe、Fe2+、Fe3+的相互转化——“铁三角”
不同价态铁元素之间转化的条件是什么?
由高价态转化低价态需要还原剂,由低价态转为高价态需要氧化剂。
实验室制取FeCl2溶液时为什么要加入少量铁屑?
加入铁屑能防止Fe2+被氧化成Fe3+。
除上述图示外,我们也可以用价类二维图来表示铁及其化合物的相互转化关系。课后请对铁及其化合物的价类二维图(下图)中的物质转化关系进行总结。
单质 氧化物 氢氧化物 盐
1.Fe只有还原性,可以被氧化成+2或+3价的铁:
如:Fe+2H+===H2↑+Fe2+ ;2Fe+3Cl2=2FeCl3 ;3Fe+4H2O==Fe3O4+4H2。
2.Fe2+既有氧化性又有还原性
如:2Fe2++Cl2===2Fe3++2Cl-;Zn+Fe2+===Fe+Zn2+;FeO+CO Fe+CO2
3.Fe3+具有较强的氧化性,可被还原为+2价或0价的铁:
如:2Fe3++Cu===2Fe2++Cu2+, 3CO+Fe2O3 2Fe+3CO2, Fe2O3+2Al 2Fe+Al2O3
【例2】下图是物质间发生化学反应时颜色的变化情况,下列选项中正确的是( )
①除去溶液中杂质用什么方法?
加足量氯水或H2O2溶液
②为什么在实验室配制FeSO4溶液中常加入少量铁粉?
防止亚铁离子被氧化,2Fe3++Fe=3Fe2+
3. 利用覆铜板制作图案
【背景】电子工业中常用覆铜板(以绝缘板为基材,一面或两面覆以铜箔,经热压而成的一种板状材料)为基础材料制作印刷电路板,印刷电路板广泛用于电视机、计算机、手机等电子产品中。用覆铜板制作印刷电路板的原理是,利用FeCl3溶液作为“腐蚀液”将覆铜板上不需要的铜腐蚀。即把预先设计好的电路在覆铜板上用蜡或不透水的物料覆盖,以保护不被腐蚀;然后,把覆铜板放到FeCl3溶液中。根据工业上制作印刷电路板的原理,我们可以利用覆铜板制作所需要的图案(如图3-12)。
【实验】取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。观察实验现象,并展示制作的图案。(1)在上述实验中,发生了什么化学反应,生成的主要产物是什么?请运用氧化还原反应的规律进行分析,并尝试写出反应的化学方程式。
2Fe3+ + Cu = 2Fe2+ + Cu2+
先加入适量的铁粉与废液中Cu2+反应,回收铜;再向废液中加人氯水等氧化剂,实现FeCl3溶液的再生。
(2)为使使用后的“腐蚀液”能得到充分利用,如何处理使用后的“腐蚀液”?
1.下列离子方程式中,正确的是( )A.铁与盐酸反应: 2Fe + 6H+ = 2Fe3+ + 3H2↑B.氯气与氯化亚铁溶液反应: 2FeCl2+Cl2=2FeCl3C.氯化铁溶液与铁反应: Fe3+ + Fe = 2Fe2+D.氯化铁溶液与氢氧化钠溶液反应: Fe3+ + 3OH- = Fe(OH)3↓
2.久置的FeSO4溶液变黄,一般认为是被氧化为Fe3+的缘故。回答下列问题:(1)久置的FeSO4溶液中Fe3+的检验:向久置的FeSO4溶液中加入KSCN的现象为___________________________,向含有Fe3+的久置的FeSO4溶液中加入少量淀粉KI溶液,发现溶液变蓝,反应的离子方程式为__________________________。 (2)除去久置FeSO4溶液中的Fe3+:在溶液中加入少量铁粉,可以观察到的现象为________;反应的离子方程式为___________,不能用铜粉作为除去FeSO4溶液中Fe3+试剂的原因:_______。
(3)查阅资料:溶液中Fe2+的氧化过程分为两步,首先是Fe2+先生成Fe(OH)2,接着被O2氧化。写出Fe(OH)2在空气中被氧化的化学方程式: __________________, 其现象为__________________________。 (4)某研究小组研究常温下不同pH对Fe2+被O2氧化的影响,如图。结合图分析不同pH对Fe2+被O2氧化的速率产生了怎样的影响: ________。
化学必修 第一册第一节 铁及其化合物教学ppt课件: 这是一份化学必修 第一册第一节 铁及其化合物教学ppt课件,共30页。PPT课件主要包含了素养要求,铁盐和亚铁盐,限时训练等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 铁及其化合物示范课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物示范课课件ppt,共25页。
高中化学必修一 专题3.1.3 铁盐和亚铁盐备课堂课件)): 这是一份高中化学必修一 专题3.1.3 铁盐和亚铁盐备课堂课件)),共22页。













