









- 7.2《物质溶解的量》第一课时 课件+教案 课件 8 次下载
- 7.2《物质溶解的量》第二课时 课件+教案 课件 7 次下载
- 7.3《溶液浓稀的表示》第二课时 课件+教案 课件 7 次下载
- 7.4《结晶现象》 课件+教案 课件 8 次下载
- 第七章 《章节综合与测试》课件 课件 7 次下载
科粤版九年级下册7.3 溶液浓稀的表示一等奖ppt课件
展开①溶液的质量 = 溶质的质量 + 溶剂的质量
②溶液的体积 ≠ 溶质的体积 + 溶剂的体积
③溶液的质量 = 溶液的密度×溶液的体积
【实验 7 – 7 】
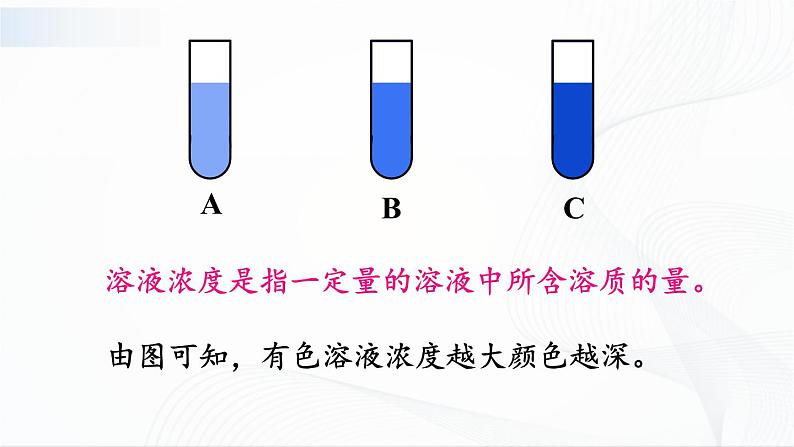
目的 知道有色溶液的颜色深浅与溶液的浓稀相关。
1. 在3支试管A、B、C 中各加入10 mL水,再分别加入约0.5 g、1 g和1.5 g固体硫酸铜(CuSO4),请猜测这3种溶液颜色深浅的顺序是__________。通过实验观察到这3种溶液颜色深浅的顺序是__________。
溶液浓度是指一定量的溶液中所含溶质的量。
由图可知,有色溶液浓度越大颜色越深。
2. 向3支分别装有20 mL、10 mL和5 mL水的D、E、F 3 支试管中,分别加入约2 g、0.5 g和1 g的固体硫酸铜(CuSO4)猜测这3种溶液颜色深浅的顺序是_________。你猜测的根据是什么? 实验观察到这3种溶液颜色深浅的顺序是_________。
思考 对氯化钠溶液而言,能否通过颜色判断溶液的浓稀呢?我们通常采用什么办法比较溶液的浓稀呢?
①有色溶液颜色的深浅,可粗略地反映溶液是浓还是稀。如不同浓度的硫酸铜溶液,颜色越深则浓度越大。
②没有颜色溶液的浓稀,则需要根据一定量溶液中所含溶质的多少进行定量的判断,这就涉及到溶液浓稀的定量表示,即溶液浓度的表示。
2.溶质的质量分数——表示溶液浓度的一种常用方法
溶质的质量分数是指溶质质量与溶液质量之比,通常以百分数表示,可用公式表示为:
3.溶解度与溶质质量分数
在一定温度下,某种固态物质在100 g溶剂中达到饱和状态时所溶解的质量
溶质的质量与溶液的质量之比
饱和溶液中溶质的质量分数达到最大值
例1 在农业生产中,常用食盐溶液去选种。现要配制80 kg溶质质量分数为15%的盐水,需要氯化钠固体和水的质量各为多少?
1. 配制一定量的某一组成的溶液,求所需溶质和溶剂的量。
解:由于100% = 1,故溶质质量分数的表达式,可写成:
即 溶质质量 = 溶液质量 ×溶质的质量分数
需要氯化钠固体的质量 = 80 kg×15% = 12 kg
水的质量 = 80 kg - 12 kg =68 kg
答:需要氯化钠固体12 kg ,水68 kg。
2. 有关溶液稀释的计算。
思考 在温度不变的条件下,如何使原有溶液的溶质质量分数减小?
溶液稀释的方法就是加入溶剂或加入低浓度的溶液。
例2 配制铅蓄电池用的28%硫酸溶液460 g,问需要 98% 的浓硫酸的体积是多少?已知98% 的浓硫酸的密度为1.84 g·cm-3。
解 设需要98%浓硫酸的质量为x,则根据稀释前后溶质质量不变的原则列得:
460 g×28% = x×98%
根据所给密度,可以求出与此相应的浓硫酸的体积。计算公式是溶液质量=溶液体积×溶液密度
答:配置28%硫酸溶液460g,需要98%浓硫酸71.4cm3。
1. 用50 g 98%的浓H2SO4配制成20%的稀H2SO4需加水的质量为( )。145 g B. 195gC. 196 g D. 245g
2. 现有一杯20 ℃的硝酸钾饱和溶液,欲改变其溶质质量分数,下列方法可行的是( )。加入一定量的硝酸钾 恒温蒸发部分水C. 升温到60 ℃ D. 加入一定量的水
A.向饱和硝酸钾溶液中,加硝酸钾时,因溶液饱和所以不再溶解,所以溶质质量分数不变;
B.饱和硝酸钾溶液当恒温蒸发水时,因温度没变所以溶解度也没变,故溶质的质量分数不变;
C.当升高温度时,饱和溶液会变为不饱和溶液,但溶液中溶质和溶剂没有变化,所以溶质的质量分数不变;
D.饱和硝酸钾中加入一定量的水,会使溶剂的质量增多,使溶质的质量分数减小。
3. 实验室有一瓶新购进的浓盐酸,其标签的部分内容如图所示,该浓盐酸的溶质是____,溶质的质量分数为_____,配制100.0 g溶质质量分数为14.8%的稀盐酸,需要这种浓盐酸的质量为___g.
4. 将60 g 20%的食盐溶液和30 g 5%的食盐溶液相混合,求所得混合溶液的溶质的质量分数。
分析:本题是混合溶液的计算,解这类题应抓住:混合溶液中溶质的质量是混合前浓、稀两种溶液中溶质质量的总和。
m浓:混合前浓溶液的质量c浓%:混合前浓溶液的溶质的质量分数m稀:混合前稀溶液的质量c稀%:混合前稀溶液的溶质的质量分数m混:混合后溶液的质量c混%:混合后溶液的溶质的质量分数m浓×c浓%+m稀×c稀%=m混×c混%
根据上式列出方程,可求c混%。解:混合溶液的质量m混=60 g+30 g = 90 g根据m浓×c浓%+m稀×c稀%=m混×c混%得
答:混合溶液的溶质的质量分数为15%。
化学九年级下册7.3 溶液浓稀的表示完美版教学课件ppt: 这是一份化学九年级下册7.3 溶液浓稀的表示完美版教学课件ppt
初中化学科粤版九年级下册7.3 溶液浓稀的表示优秀ppt课件: 这是一份初中化学科粤版九年级下册7.3 溶液浓稀的表示优秀ppt课件,文件包含第2课时配制一定溶质质量分数的溶液课件pptx、第2课时配制一定溶质质量分数的溶液doc等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
初中科粤版7.3 溶液浓稀的表示课前预习ppt课件: 这是一份初中科粤版7.3 溶液浓稀的表示课前预习ppt课件,共19页。PPT课件主要包含了溶液的浓度,经典例题,知能训练等内容,欢迎下载使用。













