








所属成套资源:科粤版化学九年级下册授课课件+教案+实验视频
- 8.3《酸和碱的反应》课件+教案+素材 课件 7 次下载
- 8.4《常用的盐》第一课时 课件+教案 课件 10 次下载
- 8.5《化学肥料》课件+教案 课件 8 次下载
- 第八章 《章节综合与测试》课件 课件 6 次下载
- 9.1《有机物的常识》课件+教案+素材 课件 9 次下载
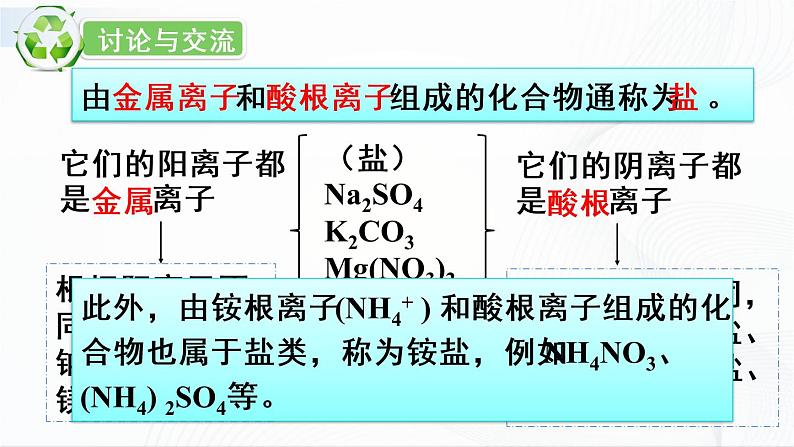
化学九年级下册8.4 常用的盐优秀课件ppt
展开这是一份化学九年级下册8.4 常用的盐优秀课件ppt,文件包含第2课时盐的化学性质课件pptx、第2课时盐的化学性质doc等2份课件配套教学资源,其中PPT共18页, 欢迎下载使用。
第2课时 盐的化学性质
【教学目标】
1.知识与技能
(1)理解盐的化学性质,并能根据盐的化学性质,写出有关的化学方程式。
(2)记住复分解反应的发生的条件,能根据复分解反应发生的条件,判断复分解反应能否发生。
2.过程与方法
(1)体验通过对知识的回顾、小组交流讨论、总结规律,学会运用规律解决实际问题。
(2)学习通过对实验现象进行分析、对比、归纳进行信息处理,获取科学结论的科学方法。
3.情感、态度与价值观
(1)通过多种教学手段、改变教学方式,激发学生的好奇心和求知欲,发展学习化学的兴趣。
(2)培养学生的合作意识以及勤于思考、勇于创新、严谨求实的科学精神。
(3)了解化学与日常生活和生产的密切关系,提高学生解决实际问题的能力。
(4)在有趣的实验与老师的点播中轻松掌握化学知识、体验到学习的快乐。
【教学重点】
对盐的化学性质进行总结。
【教学难点】
能根据复分解反应发生的条件判断酸、碱、盐之间的反应能否发生。
【教学准备】
多媒体课件、硫酸钠溶液、碳酸钠溶液、氯化钡溶液、稀硫酸、稀硝酸、试管、滴管。
一、导入新课
上一节我们学习了常见的盐的用途、分类及部分盐的溶解性情况,那么盐具有怎样的化学性质呢?请同学们拿起你的笔,写如下三个化学反应的方程式:铁和硫酸铜;碳酸钙和稀盐酸;氯化铁和氢氧化钙(每组出一个代表板演)。今天我们一起来总结盐的化学性质并学会运用。
二、推进新课
活动1 总结盐的性质
[复习]我国劳动人民很早就认识了铜盐溶液里的铜能被铁置换,从而发明了水法炼铜。它成为湿法冶金术的先驱,在世界化学史上占有光辉的一页。
水法炼铜的原理是:CuSO4+Fe==Cu+FeSO4
- 盐(可溶)+金属1→盐+金属2)
[交流]举例:
[提问]不同的盐可以由酸与碱发生中和反应得到,你知道下列各种盐可以由什么相关的酸和碱反应得到吗?
[交流](学生写在课本上,然后汇报)
[引入]我们比较系统地研究了金属、酸、碱的化学性质,下面我们进一步探究盐的化学性质。
[板书]2.盐+酸→新盐+新酸……是常用的一种制酸方法。
[学生演练](指定2名学生到黑板上写)
[讨论]这类反应要发生需要具备什么条件?
[提问]以上反应有什么共同特点?由此你发现了什么?
[交流]盐必须能溶入水或溶入酸,生成物中有沉淀或气体或水生成。
[板书]3.盐+碱→盐+碱……是常用的一种制碱方法。
[学生演练](指定2名学生到黑板上写)写出下列反应的化学方程式:
[提问]以上反应有什么共同特点?由此你发现了什么?
[小结]盐和碱必须可溶,生成物之一是沉淀或气体或水。
从1可以看出金属可置换盐溶液中的金属,那么,一种盐溶液的阴阳离子能与另一种盐溶液中的阴阳离子相互交换成分生成两种盐吗?
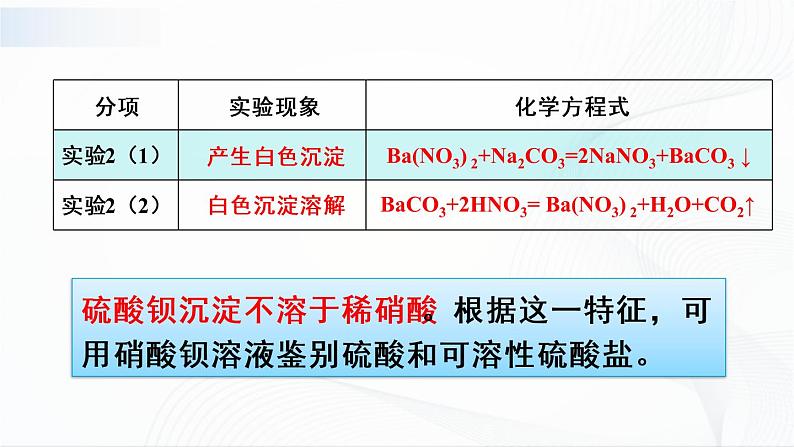
[演示]实验1、Na2CO3+BaCl2==
实验2、BaCl2+Na2SO4==
[观察]实验1、2都有沉淀生成。(独立写出以上反应的化学方程式)
[板书]4.盐(可溶)+盐(可溶)→新盐+新盐
[讨论]此类反应要发生需要具备什么条件?
[交流]两种盐必须都可溶,生成物之一是沉淀。
[小结]由上得出,两种盐之间可能发生复分解反应,生成另外两种新盐,利用上述发生复分解反应的性质,可以用来检验硫酸和硫酸盐。
[观察活动]目的 知道检验硫酸和硫酸盐的方法
(实验8-15和8-16)填写下表
[讨论]由此,你又有哪些新发现?
[交流]硫酸钡沉淀不溶于稀硝酸。根据这一特征,可用氯化钡溶液鉴别硫酸和可溶性的硫酸盐。
[讲解]酸碱盐之间以及酸与金属氧化物之间的反应都属于复分解反应,但实验证实:有的酸、碱、盐之间可以发生复分解反应,有的不能。由此可见,复分解反应发生是需要一定的条件的。那么,复分解反应发生需要怎样的条件呢?让我们先从离子的角度来分析一下前面练习中几个可以发生的复分解反应[投影]
[讲解]
[讲解]可以看出:当反应物在溶液中进行离子交换后,产物中有沉淀或气体或水生成时,复分解反应才可发生。注意:只需满足其中一个条件就可。
[讨论]请预测KNO3和NaCl能否在溶液中发生复分解反应?
[交流]不能。因为两种溶液混后没有沉淀、气体和水产生。
[过渡]怎样判定两种化合物能否发生复分解反应呢?“八字诀”有办法解决这个问题,不过先要熟悉常见酸、碱、盐的溶解性,否则八字诀没有用武之地。
[讲解]八字诀:[分类]、[关系]、[条件]、[方程]
分类;给反应物分类。确定它是否是酸?碱?盐?
关系:找出反应关系,确定是酸跟碱?酸跟盐?碱跟盐?盐跟盐中哪类反应?
条件:根据溶解性衡量反应条件是否具备?
①看反应物是否可溶(溶于水或溶于酸)。
②看预测的生成物中有无沉淀、气体、水之一生成。
方程:能反应的写出化学方程式。
[投影]
[讲解]记住这些离子的反应可以帮助我们很快地进行判断。
三、典例剖析
例 将下列各组中的两种溶液混合(溶液中的原有的水分子忽略不写):
(1)A组发生化学变化,化学方程式为 。实质是反应物1中的 (填粒子符号,下同)与反应物2中的 结合形成 。
(2)B组发生化学变化,且B组反应物1是盐的水溶液,反应物2是碱的水溶液,则B组中反应物1是 (填名称,下同),反应物2是 。
(3)C组没有发生化学反应,原因是 (微观角度解释):。
【解析】(1)氢氧化钠和盐酸能反应生成氯化钾和水,该反应的实质是盐酸中的氢离子和氢氧化钾中的氢氧根离子结合产生了水分子,(2)根据生成的物质是硫酸钠和氢氧化铜可以知道该反应是硫酸铜和氢氧化钠反应,由于反应物1是盐,故是硫酸铜,反应物2是碱,故是氢氧化钠。(3)C组实验反应前后溶液中的离子没有改变,故不发生化学反应。
【答案】(1)HCl+KOH==KCl+H2O H+ OH- H2O (2)硫酸铜溶液氢氧化钠溶液 (3)混合前后,溶液中的离子没有结合成新的分子
四、课堂检测
五、课堂小结
[提问]本节课的学习中,你又有哪些新发现?你对自己在课堂学习中的表现,是满意?是基本满意?还是不满意呢?
[小结]1.要知道盐的化学性质
2.要明确复分解反应的要点
(1)要明确反应物、生成物的种类和类别:即反应物和生成物都是两种化合物。
(2)要明确反应前后物质变化的组合形式:即反应是否“互相交换成分”。从化合价的变化来看,在复分解反应的过程中,元素的化合价均无变化,但化合物之间彼此互相交换成分。如酸与碱反应、盐与盐反应等。
(3)明确复分解反应发生的条件:即两种化合物在水溶液中要发生复分解反应必须满足一定的条件:生成物中如果有沉淀析出或气体放出,或有水生成,那么复分解反应就能发生,否则不能发生,应特别注意以上三个条件只要满足其中一个,反应就能发生。
(4)明确发生复分解反应对反应物状态的要求:
①酸与碱的反应中,这里的碱既可为可溶性的碱,又可为难溶性的碱。
②碱与盐、盐与盐的反应中,参加反应的物质都必须是可溶的。
③酸与盐的反应中,盐可不溶,但酸必溶。
六、布置作业
课本P247~P248习题2、3、4、5、7题。
8.4 常见的盐
第2课时 盐的化学性质
四、盐的化学性质
1.化学性质
(1)金属+盐(可溶)新金属+新盐
Zn+CuSO4==ZnSO4+Cu
Cu+Hg(NO3) 2== Hg+Cu(NO3)2
条件:在金属活动性顺序表中,排在前面的金属可以把排在后面的金属从它的盐溶液中置换出来。(不要用K、Ca、Na置换盐溶液中的金属)
(2)盐(溶入水或溶入酸)+酸→新盐+新酸
AgNO3+HCl==AgCl↓+HNO3
BaCl2+H2SO4==BaSO4↓+2HCl
Na2CO3+2HCl==2NaCl+CO2↑+H2O
NaHCO3+HCl==NaCl+CO2↑+H2O
(3)盐(可溶)+碱(可溶)→新盐+新碱
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3KOH==Fe(OH)3↓+3KCl
(4)盐(可溶)+盐(可溶)→两种新盐
AgNO3+NaCl==AgCl↓+NaNO3
BaCl2+Na2CO3==BaCO3↓+2NaCl
BaCl2+Na2SO4==BaSO4↓+2NaCl
五、硫酸根离子的鉴别和检验
1.加入含钡离子的试剂
2.向产生的沉淀中滴加稀硫酸
六、复分解反应发生的条件:(同时满足以下条件)
1.反应物:必须可溶(包括可溶于酸)
2.生成物:有沉淀、气体或水生成
本节课的设计从情境入手,通过复习金属与盐溶液的反应和酸碱中和反应的产物引出盐的性质、硫酸和硫酸盐的检验、复分解反应。然后进行探究实验,从实验中归纳复分解反应的条件。通过图片展示复分解反应的微观过程,引导学生从离子反应的角度来认识复分解反应的本质。最后归纳复分解反应的特点、条件、本质、类别,促使学生形成对复分解反应的系统完整的认识,能够顺利的判断复分解反应的发生和正确的书写相关的化学方程式。
相关课件
这是一份九年级下册8.4 常用的盐优秀教学ppt课件,文件包含科学版广东教育版中学化学九年级下第八章84第2课时教学课件pptx、科粤版化学九下练习docx、科粤版化学九下教学详案docx等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
这是一份2020-2021学年8.4 常用的盐精品教学ppt课件,文件包含科学版广东教育版中学化学九年级下第八章84第1课时教学课件pptx、科粤版化学九下练习docx、科粤版化学九下教学详案docx等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
这是一份2020-2021学年8.4 常用的盐完整版教学ppt课件,文件包含科学版广东教育版中学化学九年级下第八章84第3课时教学课件pptx、科粤版化学九下练习docx、科粤版化学九下教学详案docx等3份课件配套教学资源,其中PPT共20页, 欢迎下载使用。













