

高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应本单元综合与测试导学案
展开
这是一份高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应本单元综合与测试导学案,共19页。
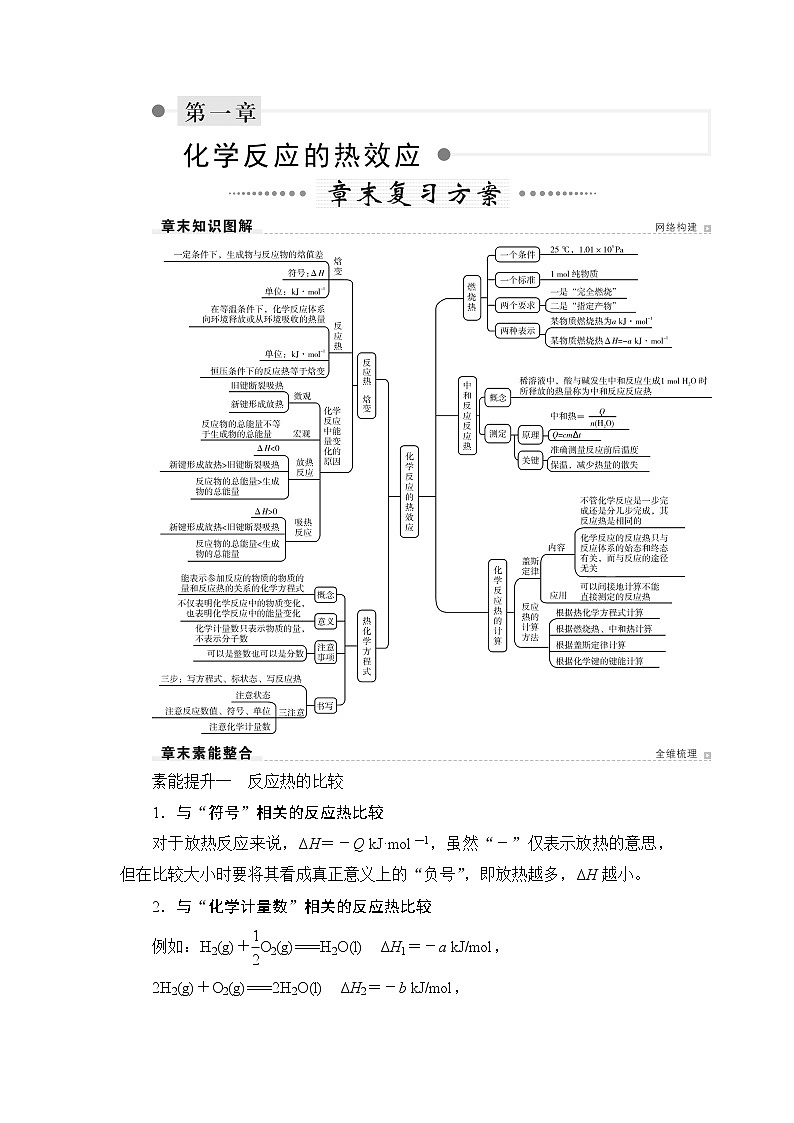
素能提升一 反应热的比较
1.与“符号”相关的反应热比较
对于放热反应来说,ΔH=-Q kJ·mol-1,虽然“-”仅表示放热的意思,但在比较大小时要将其看成真正意义上的“负号”,即放热越多,ΔH越小。
2.与“化学计量数”相关的反应热比较
例如:H2(g)+O2(g)===H2O(l) ΔH1=-a kJ/mol,
2H2(g)+O2(g)===2H2O(l) ΔH2=-b kJ/mol,
aΔH2。
3.与“中和反应反应热”相关的反应热比较
中和反应反应热是强酸和强碱的稀溶液反应生成1 mol H2O(l)放出的热量。强酸和强碱的稀溶液的中和反应反应热ΔH=-57.3 kJ/mol;弱酸、弱碱电离时吸热,反应时放出的总热量小于57.3 kJ;浓硫酸稀释时放热,反应时放出的总热量大于57.3 kJ。
4.与“物质聚集状态”相关的反应热比较
(1)同一反应,生成物状态不同时
A(g)+B(g)===C(g) ΔH1<0,
A(g)+B(g)===C(l) ΔH2<0,
因为C(g)===C(l) ΔH3<0,而ΔH3=ΔH2-ΔH1,所以ΔH2<ΔH1。
(2)同一反应,反应物状态不同时
S(g)+O2(g)===SO2(g) ΔH1<0
S(s)+O2(g)===SO2(g) ΔH2<0
ΔH2+ΔH3=ΔH1,则ΔH3=ΔH1-ΔH2,又ΔH3<0,所以ΔH1<ΔH2。
5.与“可逆反应”相关的反应热比较
如3H2(g)+N2(g)2NH3(g) ΔH=-92.2 kJ/mol,指生成2 mol NH3(g)时放出92.2 kJ的热量,而不是3 mol H2(g)和1 mol N2(g)混合,在一定条件下反应就可放出92.2 kJ的热量,实际上3 mol H2(g)和1 mol N2(g)混合,在一定条件下反应放出的热量小于92.2 kJ,因为该反应为可逆反应,反应物不能完全转化为生成物。
【典例1】 (2020·浙江卷)关于下列ΔH的判断正确的是( )
CO(aq)+H+(aq)===HCO(aq) ΔH1
CO(aq)+H2O(l)HCO(aq)+OH-(aq) ΔH2
OH-(aq)+H+(aq)===H2O(l) ΔH3
OH-(aq)+CH3COOH(aq)===CH3COO-(aq)+H2O(l) ΔH4
A.ΔH10,故ΔH2>ΔH1,A项错误;由③知Sn(灰,s)转化为Sn(白,s)是吸热的,当温度低于13.2 ℃时Sn(白,s)自动转化为Sn(灰,s),灰锡为粉末状,由题知锡在常温下以白锡状态存在,B、C项错误,D项正确。
13.下列有关热化学方程式的叙述正确的是( )
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-480.4 kJ·mol-1,则H2的燃烧热为240.2 kJ·mol-1
B.已知甲烷氧化CH4(g)+O2(g)===CO2(g)+2H2(g)ΔH=-322.0 kJ·mol-1,则反应物的键能总和大于生成物的键能总和
C.已知N2(g)+3H2(g)2NH3(g) ΔH=-92.0 kJ·mol-1,则将1 mol N2(g)和3 mol H2(g)置于一密闭容器中充分反应后放出的热量等于92.0 kJ
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为HCl(aq)+NaOH(aq)===H2O(l)+NaCl(aq) ΔH=-57.4 kJ·mol-1
答案 D
解析 1 mol H2完全燃烧生成液态水时能量变化为燃烧热,题给反应水不是液态,A项错误;焓变为负,可知反应物的键能总和小于生成物的键能总和,B项错误;合成氨为可逆反应,热化学方程式中为完全转化时的能量变化,则将1 mol N2(g)和3 mol H2(g)置于一密闭容器中充分反应后放热小于92.0 kJ,C项错误;n(NaOH)==0.5 mol,与稀盐酸完全中和,放出28.7 kJ的热量,可知HCl(aq)+NaOH(aq)===H2O(l)+NaCl(aq) ΔH=-57.4 kJ·mol-1,D项正确。
14.根据以下热化学方程式,ΔH1和ΔH2的大小比较正确的是( )
A.已知反应2S(s)+2O2(g)===2SO2(g) ΔH
相关学案
这是一份高中化学人教版 (2019)选择性必修1第一节 反应热学案,共6页。
这是一份人教版 (2019)选择性必修1第一节 原电池导学案,共5页。学案主要包含了学科核心素养与教学目标,重点难点,教法与学法,教学过程,教学反思等内容,欢迎下载使用。
这是一份化学选择性必修1第二节 反应热的计算导学案及答案,共15页。









