





初中物理沪教版九年级下册9.1 原子获奖教课ppt课件
展开2H2O O2 + 2H2
原子是 最小微粒。
人类对“物质构成”的思考
由于不可能用肉眼看到原子内部的情况,物理学家只能根据
物理学家头脑中所构成的原子内部情况的
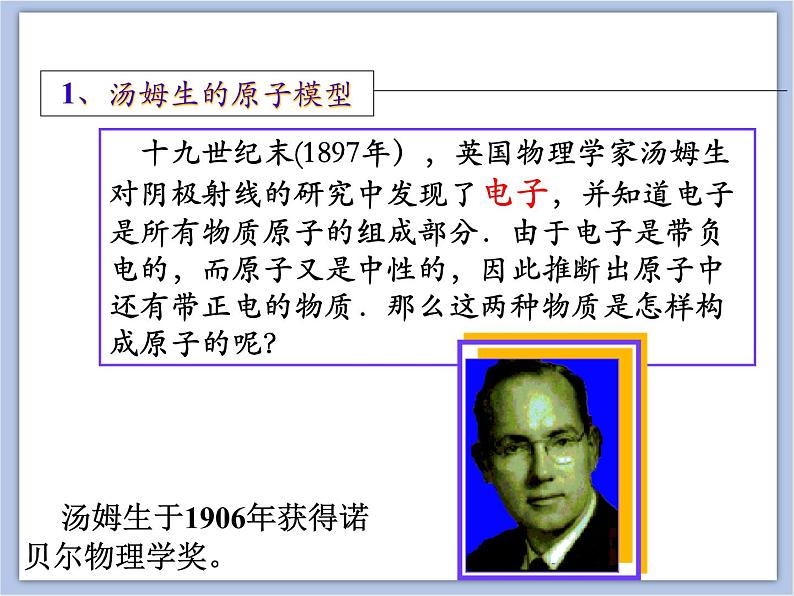
十九世纪末(1897年),英国物理学家汤姆生对阴极射线的研究中发现了电子,并知道电子是所有物质原子的组成部分.由于电子是带负电的,而原子又是中性的,因此推断出原子中还有带正电的物质.那么这两种物质是怎样构成原子的呢?
汤姆生于1906年获得诺贝尔物理学奖。
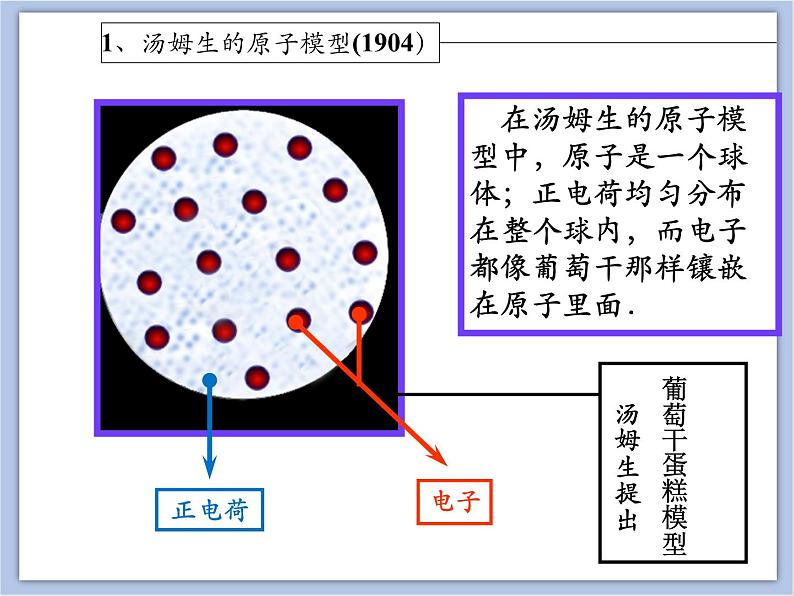
在汤姆生的原子模型中,原子是一个球体;正电荷均匀分布在整个球内,而电子都像葡萄干那样镶嵌在原子里面.
葡萄干蛋糕模型汤姆生提出
根据汤姆生模型计算的结果:电子质量很小,对α 粒子的运动方向不会发生影响;由于正电荷均匀分布,对α 粒子的影响也很小,故α 粒子偏转角度不会很大.
1、绝大多数α 粒子穿过金箔后仍沿原来方向前进.
2、极少数α 粒子发生了较大的偏转.
3、个别粒子的偏转几乎达到180 °.
第一条现象说明:原子中绝大部分是空的.
第二、三现象说明:α 粒子前进时撞在一个体积很小而质量又比它大很多的微粒上.
在卢瑟福的原子模型中,原子是一个球体;带正电的原子核处于原子中央,而电子都像行星围绕太阳旋转那样围绕原子核旋转.
进一步实验表明:原子里的电子不像行星围绕太阳旋转时有固定的轨道,而是形成“电子云”,所以现在提出的原子模型——电子云模型.
1、汤姆生—— 葡萄干蛋糕模型2、卢瑟福—— 行星模型3、电子云模型
原子的直径: 10-10米
原子核的直径:10-15米
不同元素的核外电子数是多少?又是如何分布的呢?
电子绕原子核按一定几率高速旋转
氢原子(1个电子)
二、核外电子的运动和排布
钠原子的结构(11个电子)
第二层(6个)(最外层)
根据氧原子的结构图画出结构示意图
⑴第一层最多容纳___个电子,第二层最多容纳___个电子。
(2)最外层不超过 个电子,只有1层的不超过___个电子。
⑶电子先排满第___层,再排第___层,排满第___层,再排第___层。(按照能量由低到高的顺序分层排布)
2. 核外电子的排布规律:
⑴第一层最多容纳2个电子,第二层最多容纳8个电子。
(2)最外层不超过8个电子,只有1层的不超过2个电子。
⑶电子先排满第1层,再排第2层,排满第2层,再排第3层。(按照能量由低到高的顺序分层排布)
都为 8(氦为2)
三、元素化学性质与原子最外层电子数的关系密切
四、元素常见化合价与原子最外层电子数的关系密切
化学变化的过程仅仅是核外电子发生相应的变化,比如得失电子,原子核不会改变,原子种类也不变。
1919年,卢瑟福又用速度是20000公里/秒的“子弹” ——α粒子去轰击氮、氟、钾等元素的原子核时,发现在原子核中还存在一种带正电的质量比电子大很多的微粒——质子
质子所带正电荷的数量=电子所带负电荷的数量
原子质量≈原子核的质量
卢瑟福在1920年,他提出了假说:原子核里应该还存在一种“中性”的微粒,它不带电,它的质量等于质子的质量。
卢瑟福把它命名为“中子”。
1932年英国物理学家查德威克在剑桥大学卡文迪许实验室发现:中子。
查德威克于1935年获得诺贝尔物理学奖。
质子和中子还能再分吗?
蕴藏在原子核中的能量叫做核能。释放核能有两种方式:核裂变和核聚变。
哪些元素能释放核能呢?
从人类对原子结构探索历程,我们能得到什么启发
物理九年级下册9.1 原子教课课件ppt: 这是一份物理九年级下册9.1 原子教课课件ppt,共15页。PPT课件主要包含了约翰·道尔顿,约瑟夫·约翰·汤姆生,诺奖幼儿园,欧内斯特·卢瑟福,“鳄鱼”,电子云模型等内容,欢迎下载使用。
物理九年级下册8.1 电功率教课课件ppt: 这是一份物理九年级下册8.1 电功率教课课件ppt,共13页。PPT课件主要包含了聪明的灯,PUI,课堂小结等内容,欢迎下载使用。
沪教版九年级上册6.1 密度教课课件ppt: 这是一份沪教版九年级上册6.1 密度教课课件ppt,共7页。PPT课件主要包含了小小鉴别师,实验探究,延时符,实验结论等内容,欢迎下载使用。













