


人教版 (2019)选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质教学演示课件ppt
展开第1课时 键的极性与分子的极性 范德华力和氢键及其对物质性质的影响
一、键的极性和分子的极性
共用电子对无偏向(电荷分布均匀)
共用电子对有偏向(电荷分布不均匀)
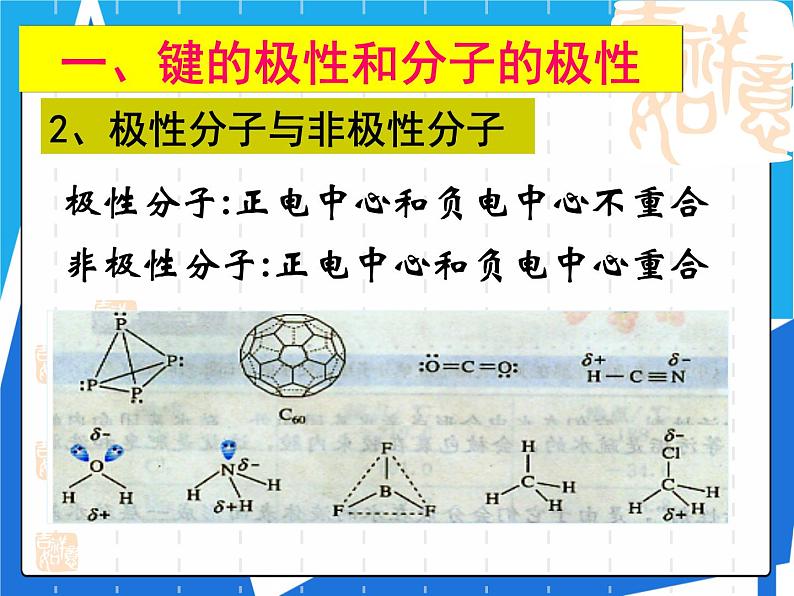
2、极性分子与非极性分子
极性分子:正电中心和负电中心不重合
非极性分子:正电中心和负电中心重合
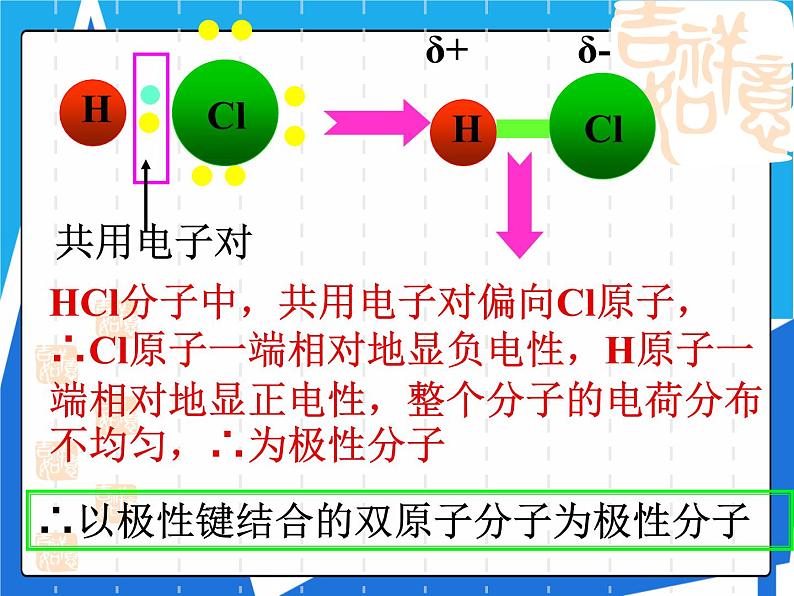
HCl分子中,共用电子对偏向Cl原子,∴Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子的电荷分布不均匀,∴为极性分子
∴以极性键结合的双原子分子为极性分子
含有极性键的分子一定是极性分子吗?
分析方法:从力的角度分析
在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消)。
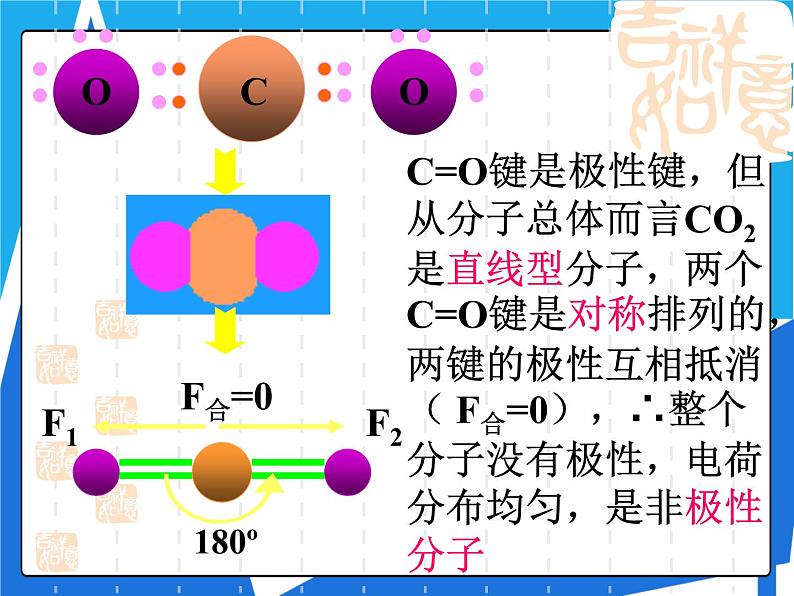
C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子
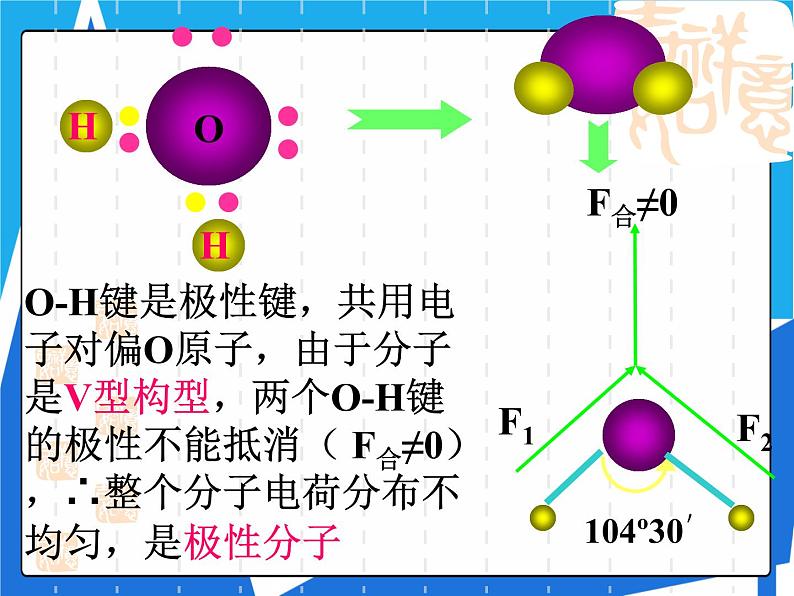
O-H键是极性键,共用电子对偏O原子,由于分子是V型构型,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子
三角锥型, 不对称,键的极性不能抵消,是极性分子
平面三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子
正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子
1、常见分子的构型及分子的极性
H2、Cl2 无 无 直线型 非极性
HCl 有 无 直线型 极性
H2O 有 104.5 º 折线型 极性
CO2 有 180º 直线型 非极性
NH3 有 107.3º 三角锥型 极性
BF3 有 120º 平面三角形 非极性
CH4 有 109º28 ' 正四面体型 非极性
键的极性与分子极性的关系
1、都是由非极性键构成的分子一般是非极性分子。特殊:032、极性键结合形成的双原子分子一定为极性分子。3、极性键结合形成的多原子分子,可能为非极性分子,也可能为极性分子。4、多原子分子的极性,应有键的极性和分子的空间构型共同来决定。
2、判断ABn型分子极性的经验规律:
若中心原子A的化合价的绝对值等于该元素原子的最外层电子数,则为非极性分子,若不等则为极性分子。
判断下列分子是极性分子还是非极性分子:
PCl3、CCl4、CS2、SO2
二、范德华力及其对物质性质的影响
气体在加压或降温是为什么会变为液体、固体?
因为存在一种把分子聚集在一起的作用力而我们把这种作用力称为分子间作用力,又叫范德华力。
范德华力很弱,约比化学键能小1-2数量级
(2) 范德华力与相对分子质量的关系
结构相似,相对分子质量越大,范德华力越大
(3)范德华力与分子的极性的关系
相对分子质量相同或相近时,分子的极性越大,范德华力越大
(4)范德华力对物质熔沸点的影响
把分子聚集在一起的作用力
影响物质的化学性质和物理性质
影响物质的物理性质(熔、沸点及溶解度等)
氢键:是由已经与电负性很强的原子形成共价键的氢原子(如水分子中的氢)与另一个分子中电负性很强的原子(如水分子中的氧)之间的作用力。
三、氢键及其对物质性质的影响
是一种静电作用,是除范德华力外的另一种分子间作用力,氢键的大小,介于化学键与范德华力之间,不属于化学键。但也有键长、键能。
氢键普遍存在于已经与N、O、F形成共价键的氢原子与另外的N、O、F原子之间。
如:HF、H2O、NH3 相互之间
C2H5OH、CH3COOH、H2O相互之间
(2)分子内氢键 某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构.
(2)分子内氢键:
例如 (1)分子间氢键:
氢键介于范德华力和化学键之间,是一种较弱的作用力。
氢键强弱与X和Y的吸引电子的能力有关,即与X和Y的电负性有关.它们的吸引电子能力越强(即电负性越大),则氢键越强,如F原子得电子能力最强,因而F-H…F是最强的氢键; 原子吸引电子能力不同,所以氢键强弱变化顺序为: F-H…F > O-H…O > O-H…N > N-H…N C原子吸引电子能力较弱,一般不形成氢键。
7、氢键对物质熔沸点影响:
分子间氢键使物质熔沸点升高分子内氢键使物质熔沸点降低
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子内氢键时使溶质溶解度减小。
8、氢键对物质溶解度的影响:
范德华力、氢键及共价键的比较
1.下列关于范德华力与氢键的叙述中正确的是 ( )A.任何物质中都存在范德华力,而氢键只存在于含有N、O、F的物质中B.范德华力比氢键的作用还要弱C.范德华力与氢键共同决定物质的物理性质D.范德华力与氢键的强弱都只与相对分子质量有关
2、下列关于氢键的说法中正确的是( )A. 每个水分子内含有两个氢键B. 在所有的水蒸气、水、冰中都含有氢键C. 分子间能形成氢键,使物质的熔沸点升高D. HF稳定性很强,是因为其分子间能形成氢键
有分子间氢键,例如:熔沸点:H2O>H2S
稳定性是化学键(H—F共价键强)决定的
3.下列事实不能用氢键来解释的( )A.冰的密度比水小,能浮在水面上B.NH3的沸点比PH3高C.邻羟基苯甲醛的沸点低于对羟基苯甲醛D.H2O的分解温度比H2S高得多
4.下列说法不正确的是( )A.HF、HCl、HBr、HI的熔、沸点升高只与范德华力大小有关B.H2O的熔、沸点高于H2S,是由于水分子之间存在氢键C.乙醇与水互溶可以用“相似相溶”和氢键来解释D.邻羟基苯甲酸的熔点比对羟基苯甲酸的熔点低
人教版 (2019)选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质备课ppt课件: 这是一份人教版 (2019)选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质备课ppt课件,共29页。PPT课件主要包含了课前导入,电子式,结构式,非极性键,极性键,极性键和非极性键,极性分子,非极性分子,HCl,大小相等方向相反等内容,欢迎下载使用。
人教版 (2019)选择性必修2第三节 分子结构与物质的性质完美版习题课件ppt: 这是一份人教版 (2019)选择性必修2第三节 分子结构与物质的性质完美版习题课件ppt,共33页。
高中化学第二章 分子结构与性质第三节 分子结构与物质的性质教学演示ppt课件: 这是一份高中化学第二章 分子结构与性质第三节 分子结构与物质的性质教学演示ppt课件,共21页。PPT课件主要包含了你知道吗,分子的极性,F合=0,CO2,º28,CH4,°30',F合≠0,H2O,NH3等内容,欢迎下载使用。













