




所属成套资源:2022届高三统考化学人教版一轮课件(共47份)
2022届高三统考化学人教版一轮课件:第6单元 第2节 原电池 化学电源
展开
这是一份2022届高三统考化学人教版一轮课件:第6单元 第2节 原电池 化学电源,共60页。PPT课件主要包含了-2-,-3-,考点一,考点二,基础梳理,考点突破,考点三,-4-,-5-,-6-等内容,欢迎下载使用。
考纲要求:1.理解原电池的构成、工作原理及应用,能书写电极反应和总反应方程式。 2.了解常见化学电源的种类及工作原理。
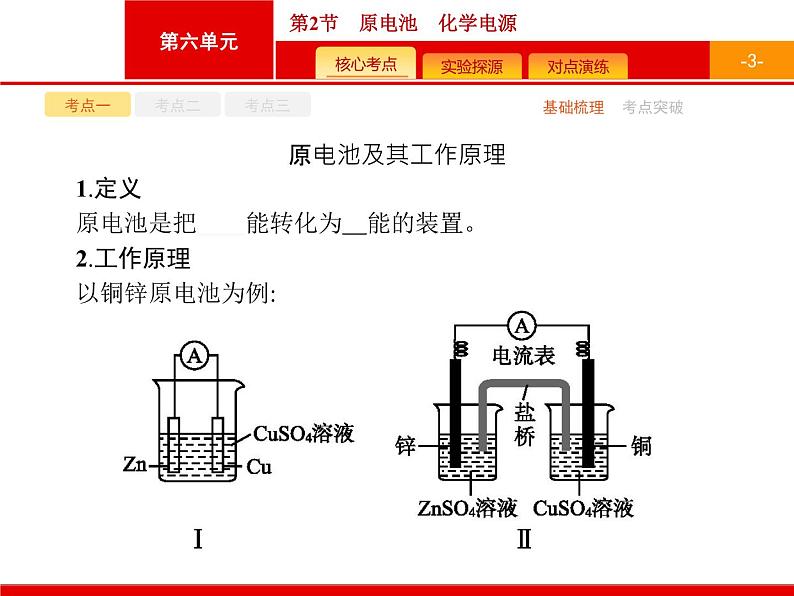
原电池及其工作原理1.定义原电池是把化学能转化为电能的装置。2.工作原理以铜锌原电池为例:
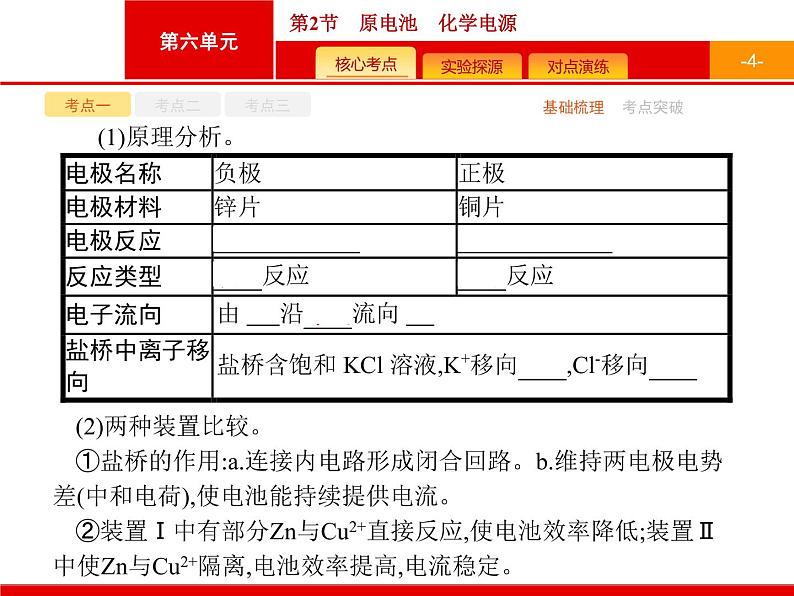
(2)两种装置比较。①盐桥的作用:a.连接内电路形成闭合回路。b.维持两电极电势差(中和电荷),使电池能持续提供电流。②装置Ⅰ中有部分Zn与Cu2+直接反应,使电池效率降低;装置Ⅱ中使Zn与Cu2+隔离,电池效率提高,电流稳定。
特别提醒(1)只有能自发进行的氧化还原反应才能设计成原电池。(2)活动性强的金属不一定作负极,但负极一定发生氧化反应。(3)电子不能通过电解质溶液,溶液中的离子不能通过盐桥。(4)负极失去电子总数一定等于正极得到电子总数。(5)对于同一反应,原电池反应速率一定比直接发生的氧化还原反应的速率大,原因是电子的移动定向了,故反应速率增大。
自主巩固判断正误,正确的画“√”,错误的画“×”。(1)原电池可将化学能转化为电能,原电池需外接电源才能工作 ( × )(2)NaOH溶液与稀硫酸反应是放热反应,此反应可以设计成原电池 ( × )(3)Fe+CuSO4==FeSO4+Cu的反应可以设计成原电池 ( √ )(4)氧化还原反应2H2O 2H2↑+O2↑可以设计成原电池 ( × )(5)同种条件下,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长 ( √ )(6)在原电池中,发生氧化反应的一极一定是负极 ( √ )(7)在原电池中,负极材料的活动性一定比正极材料的活动性强( × )
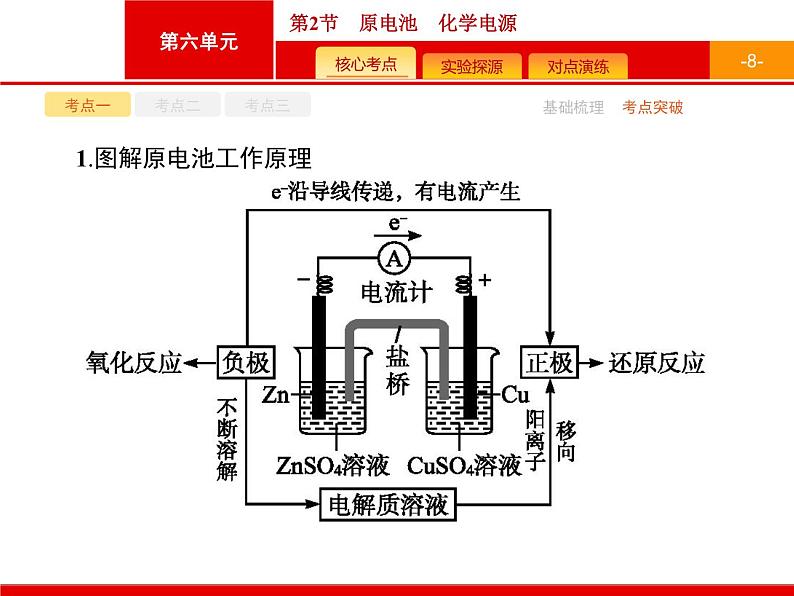
1.图解原电池工作原理
2.原电池中正、负极的判断判断原电池的正负极需抓住闭合回路和氧化还原反应进行分析,如图
注意:原电池的正负极与电极材料的性质有关,也与电解质溶液有关,不要形成思维定式——活泼金属一定是负极。如Al、Mg和NaOH溶液构成的原电池中,Al为负极,Mg为正极。
例2如图是某同学设计的原电池装置,下列叙述中正确的是( )A.氧化剂和还原剂必须直接接触才能发生反应B.电极Ⅱ上发生还原反应,作原电池的正极C.该原电池的总反应式为2Fe3++Cu==Cu2++2Fe2+D.盐桥中装有含氯化钾的琼脂,K+移向负极区
答题模板 书写电极反应式的三个步骤列物质标得失—按照负极发生氧化反应,正极发生还原反应,判断出电极反应物和产物,找出得失电子的数量。↓看环境配守恒—电极产物在电解质溶液的环境中,应能稳定存在,如碱性介质中生成的H+应让其结合OH-生成水。电极反应式要遵守电荷守恒、质量守恒和得失电子守恒等,并加以配平。↓两式加验总式—两电极反应式相加,与总反应方程式对照验证。
跟踪训练1.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是( )。A.铜电极上发生氧化反应B.电池工作一段时间后,甲池的 减小C.电池工作一段时间后,乙池溶液的总质量增加D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
2.(1)观察如图四个装置,回答下列问题:
①装置a和b中铝电极上的电极反应式分别为 , 。②装置c中产生气泡的电极为 (填“铁”或“铜”)电极,装置d中铜电极上的电极反应式为 。
(2)观察如图两个装置,图甲装置中铜电极上产生大量的无色气泡,图乙装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为 、 。
原电池原理的应用原电池在化工、农业生产及科学研究中的应用1.加快氧化还原反应速率一个自发的氧化还原反应,设计成原电池时反应速率增大,例如Zn与稀硫酸反应时加入少量的CuSO4溶液能使产生氢气的速率增大。2.比较金属活动性强弱金属分别作原电池的两极时,一般作负极的金属活动性比作正极的强。3.金属的防护使被保护的金属制品作原电池的正极而得到保护。例如,保护铁制输水管或钢铁桥梁,可用导线将其和一块锌块相连,使Zn作原电池的负极。
4.设计制作化学电源(1)首先将氧化还原反应分成两个半反应。(2)根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。
自主巩固(1)用稀硫酸与锌粒反应制取氢气,加入少量硫酸铜可以增大化学反应速率的原因:Zn与CuSO4反应生成Cu,形成铜锌原电池,可以增大反应速率。(2)A、B两种金属用导线连接,放入稀硫酸中,B的质量逐渐减小,则两种金属的活动性A③>②>④B.①>③>④>②C.③>④>②>①D.③>①>②>④
解析:由原电池原理判断金属活动性,外电路电流从②流向①,②为正极,金属活动性①>②;①③相连,③为正极,金属活动性①>③;②④相连,②上有气泡(H2)逸出,②为正极,金属活动性④>②;③④相连,③质量减少,则金属活动性③>④,即金属活动性顺序为①>③>④>②,B正确。
4.向两份等质量的铁粉a、b中分别加入过量的稀硫酸,同时向b中加入少量的CuSO4溶液,下列各图表示的是产生H2的体积V(同温同压下测定)与时间t的关系,其中正确的是( )
解析:因为b中有一部分铁粉与硫酸铜反应生成Cu,Fe、Cu和稀硫酸构成原电池,使反应速率加快,反应完成所需的时间缩短,但产生氢气的体积小于a。
5.(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 (填字母)。 A.C(s)+H2O(g)==CO(g)+H2(g) ΔH>0B.2H2(g)+O2(g)==2H2O(l) ΔH
相关课件
这是一份新高考化学一轮复习课件 第6章 第35讲 原电池 化学电源,共60页。PPT课件主要包含了高考化学一轮复习策略,原电池化学电源,归纳整合,专项突破,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习第6章化学反应与能量第2讲原电池化学电源课件
这是一份人教版高考化学一轮复习第6单元化学反应与能量第2节原电池化学电源课件









