




所属成套资源:2022版高考化学选考山东专用一轮总复习课件(共38份)
2022版高考化学选考山东专用一轮总复习课件:专题八化学键分子结构与性质 —基础篇
展开
这是一份2022版高考化学选考山东专用一轮总复习课件:专题八化学键分子结构与性质 —基础篇,共28页。
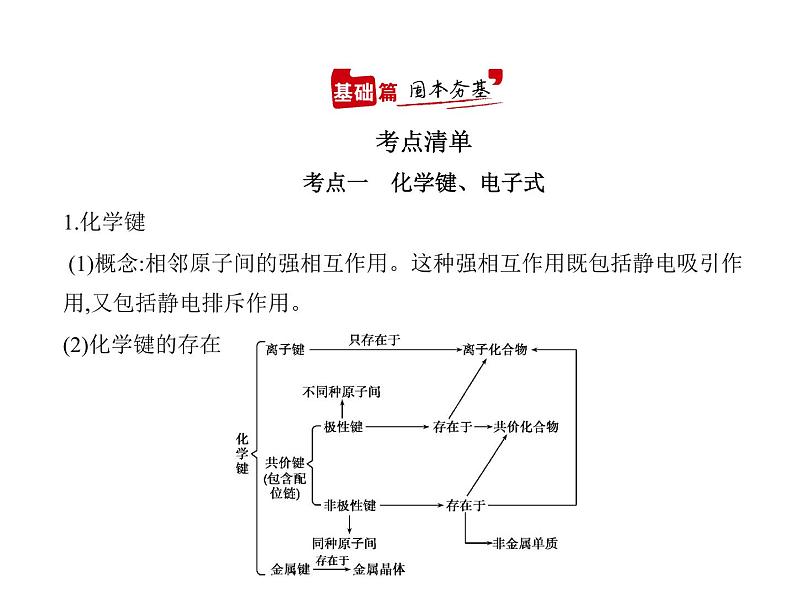
考点一 化学键、电子式1.化学键 (1)概念:相邻原子间的强相互作用。这种强相互作用既包括静电吸引作
用,又包括静电排斥作用。(2)化学键的存在
说明 a.离子化合物中一定含有离子键,离子键只能存在于离子化合物
中。b.共价键可存在于离子化合物、共价化合物和单质中。c.熔融状态下离子键断裂,共价键不断裂,可以通过在熔融状态下是否导
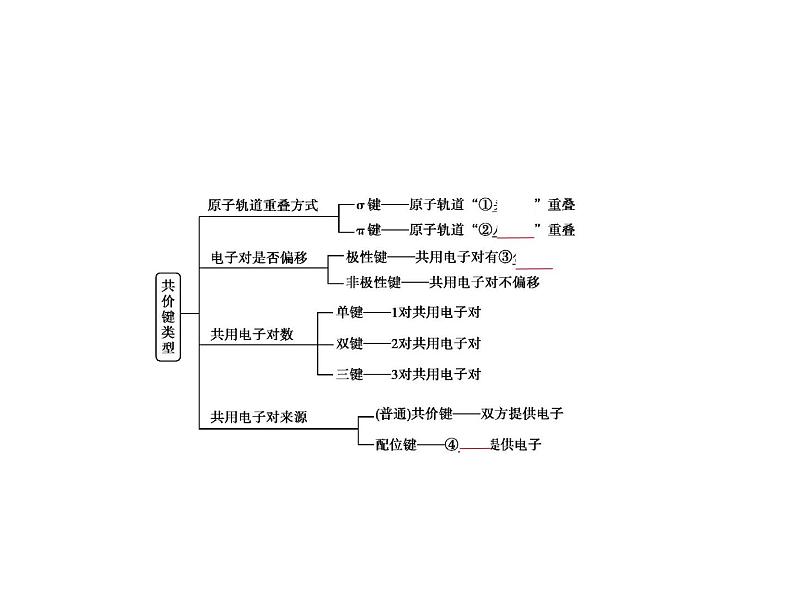
电来区分离子化合物和共价化合物。d.既有化学键断裂又有化学键形成的变化才是化学变化。2.共价键(1)共价键的类型
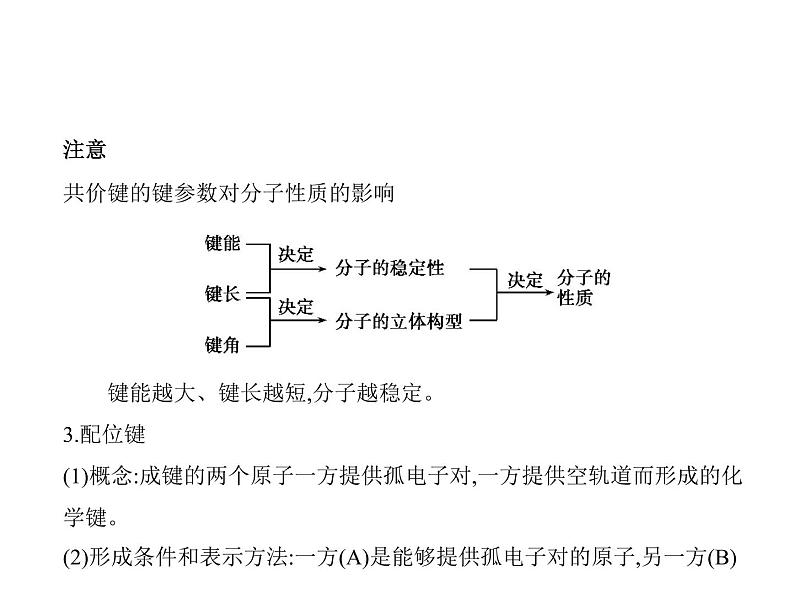
注意 a.单键为σ键,双键含1个σ键和1个π键,三键含1个σ键和2个π键。b.成键原子半径越大,π键越难形成,如Si、O之间难形成双键。c.并不是所有的共价键都有方向性,如s-s σ键没有方向性。d.原子形成共价健时优先形成σ键。(2)共价键的键参数a.键能:气态基态原子形成1 ml化学键释放的最低能量,通常取正值。键
能越大,化学键越稳定。b.键长:形成共价键的两个原子之间的⑤ 核间距 。键长越短,键能越
大,共价键越稳定。c.键角:在多原子分子中,两个共价键之间的夹角。
注意 共价键的键参数对分子性质的影响 键能越大、键长越短,分子越稳定。3.配位键(1)概念:成键的两个原子一方提供孤电子对,一方提供空轨道而形成的化
学键。(2)形成条件和表示方法:一方(A)是能够提供孤电子对的原子,另一方(B)
是具有能够接受孤电子对的空轨道的原子,用符号A→B表示。(3)配位化合物(简称配合物)a.概念:组成中含有配位键的物质;b.构成:由中心原子或中心离子[金属的原子或离子(有空轨道)]与配体[含
有孤电子对的分子(如NH3、H2O)或离子(如Cl-、OH-)]通过配位键构成。(4)配合物的制备与应用a.制备[Cu(NH3)4](OH)2Cu2++2NH3·H2O Cu(OH)2↓+2N Cu(OH)2+4NH3 [Cu(NH3)4]2++2OH-b.制备银氨溶液Ag++NH3·H2O AgOH↓+N
AgOH+2NH3·H2O [Ag(NH3)2]++OH-+2H2Oc.有些配合物显现出特征颜色,从而可用于物质的检验,如用SCN-检验Fe3
+,NH3与Cu2+配位生成[Cu(NH3)4]2+呈现更深的蓝色。d.利用金属离子与其配合物的性质不同,进行溶解、沉淀、萃取等操作
来达到分离提纯、分析检测等目的。4.金属键(1)概念:金属中“自由电子”和金属阳离子之间存在的强相互作用。本
质上是一种电性作用。(2)特征a.金属键没有方向性和饱和性;b.金属键中的电子在整个三维空间里运动,属于整块固态金属。
(3)金属不透明,具有金属光泽及良好的导电性、导热性和延展性,这些性
质都与金属键密切相关。
点拨 金属导电是由于自由电子的定向移动,属于物理变化,电解质溶液
导电是由于阴、阳离子在溶液中定向移动并在阳极、阴极放电的过程,
是化学变化。5.电子式(1)概念:在元素符号周围用“·”或“×”来表示原子的最外层电子的式
子。(2)书写方法
(3)用电子式表示化合物的形成过程a.离子化合物,如NaCl: b.共价化合物,如HCl:H×+· ·· H·× ··
考点二 分子的空间结构与分子性质1.用价层电子对互斥(VSEPR)理论推测分子的空间结构(1)用价层电子对互斥理论推测分子的空间结构的关键是判断分子中的
中心原子上的价层电子对数。 其中:a是中心原子的价电子数(阳离子要减去电荷数、阴离子要加上电
荷数),b是与中心原子结合的原子最多能接受的电子数,x是与中心原子结
合的原子数。(2)价层电子对互斥理论与分子的空间结构
2.杂化轨道理论(1)杂化轨道理论概述当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数量相等的能
量相同的杂化轨道。参与杂化的轨道不同,杂化轨道间的夹角不同,形成
分子的空间结构不同。(2)杂化轨道三种类型
3.手性分子具有完全相同的组成和原子排列方式的一对分子,如同左手与右手一样,
镜面对称,却在三维空间里不能重叠,互称手性异构体,具有手性异构体的
分子叫手性分子。4.分子极性(1)分子构型与分子极性的关系
(2)键的极性、分子空间结构与分子极性的关系
特别提醒 (1)极性分子中可能含有非极性键,如H2O2为极性分子,但含有
非极性共价键O—O键。(2)只含有极性键的分子可能是非极性分子,如CH4、CO2等分子中只含有
极性键,属于非极性分子。5.分子间作用力 (1)概念:物质分子之间存在着多种相互作用力,统称为分子间作用力。(2)分类:分子间作用力最常见的是范德华力和氢键。(3)强弱:范德华力
相关课件
这是一份山东专用高考化学一轮复习专题八化学键分子结构与性质_基础篇课件,共28页。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题四氧化还原反应 —基础篇,共24页。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十九物质的检验、分离与提纯 —基础篇,共23页。PPT课件主要包含了考点清单,2化学方法,知能拓展,常见阳离子的检验,常见阴离子的检验等内容,欢迎下载使用。









