


所属成套资源:2022版高考化学选考山东专用一轮总复习课件(共38份)
2022版高考化学选考山东专用一轮总复习课件:专题二物质的量 —应用篇
展开
这是一份2022版高考化学选考山东专用一轮总复习课件:专题二物质的量 —应用篇,共9页。
实践探究关系式法在化学计算中的应用关系式是表示两种或多种物质之间物质的量关系的一种简化式子。在
多步反应中,它可以把始态的反应物与终态的生成物之间的物质的量关
系表示出来,把多步计算简化成一步计算。正确书写关系式是解答化学
计算题的关键。解题要领 首先,找出作为中介的物质,并确定最初反应物、中介物质、
最终生成物之间的物质的量关系;然后,根据已知条件及关系式列出比例
式进行计算求解。
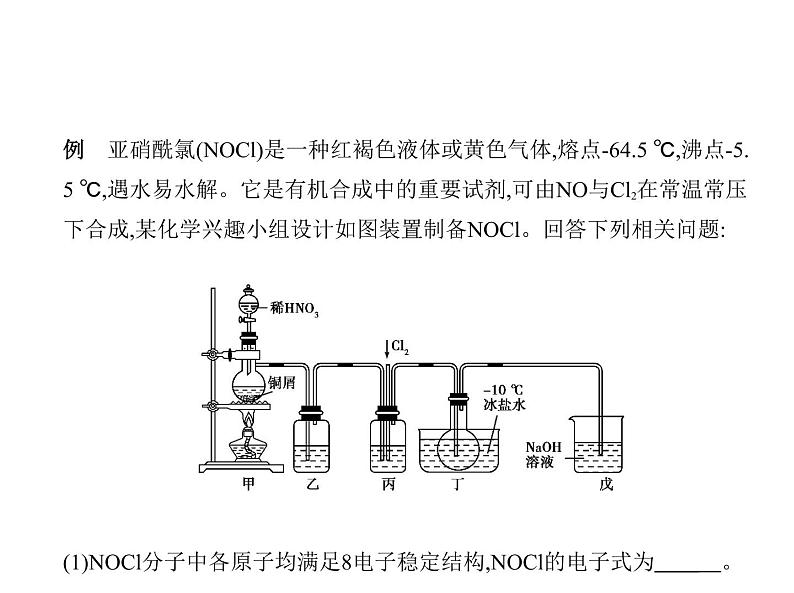
例 亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点-64.5 ℃,沸点-5.
5 ℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压
下合成,某化学兴趣小组设计如图装置制备NOCl。回答下列相关问题: (1)NOCl分子中各原子均满足8电子稳定结构,NOCl的电子式为 。
(2)装置乙中的液体为 ,装置丙的作用是 。(3)实验时,先通入Cl2,观察到丁中烧瓶内充满黄绿色气体时,再通入NO,这
样操作目的是 。待丁中烧瓶内有一定量
液体生成时,停止实验。(4)上述装置设计有一不妥之处,理由是 (用化
学方程式表示)。(5)测定NOCl的纯度:取所得产物a g溶于水,配制成250 mL溶液;取25.00
mL于锥形瓶中,以K2Cr2O7溶液为指示剂,用c ml/L AgNO3标准溶液滴定
至终点,消耗标准溶液的体积为24.00 mL。滴定终点的现象是 ,
亚硝酰氯(NOCl)的纯度为 。[Ag2CrO4呈砖红色;Ksp(Ag-
Cl)=1.56×10-10,Ksp(Ag2CrO4)=1.0×10-12,Ksp(AgNO2)=5.86×10-4]。
解题导引 第(5)问中,要求亚硝酰氯的纯度,需求出a g产物中所含亚硝酰氯的质量,根据NOCl+H2O HNO2+HCl及HCl+Ag-NO3 AgCl↓+HNO3两步连续反应中化学计量关系可得到关系式:NOCl~HCl~AgNO3,n(NOCl)=n(AgNO3),可根据数据求出25 mL溶液中所
含NOCl的物质的量,再进行后续计算。
解析 (1)NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为 。(2)乙的作用是吸收NO中混有的HNO3,HNO3易溶于水,NO不溶于水,可用
水吸收NO中混有的HNO3;NOCl遇水水解,在制备NOCl之前应将水吸收,
装置丙可盛放浓硫酸,同时装置丙可将NO和Cl2混合,根据原子守恒可知:
Cl2和NO物质的量之比为1∶2时恰好完全反应,可以通过观察丙中气泡调
节通入的流速使Cl2和NO的量接近1∶2。(3)实验之前,装置内有空气,NO能被空气中的氧气迅速氧化,为防止NO被
氧气氧化,实验时,先通入Cl2,观察到丁中烧瓶内充满黄绿色气体时,空气
被排尽,此时再通入NO。(4)戊装置中有水,水蒸气进入装置丁的烧瓶中使NOCl水解,发生反应:
NOCl+H2O HNO2+HCl。(5)Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1.0×10-12,Ksp(AgNO2)=5.86×10-4,AgCl
饱和溶液中c(Ag+)= ×10-5 ml/L,Ag2CrO4饱和溶液中c(Ag+)≈1.26×10-4ml/L,AgNO2饱和溶液中c(Ag+)= ×10-2ml/L,即溶解度:AgCl
相关课件
这是一份山东专用高考化学一轮复习专题二物质的量_基础篇课件,共25页。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十九物质的检验、分离与提纯 —应用篇,共6页。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十化学能与热能 —应用篇,共17页。








