





所属成套资源:2022版高考化学选考山东专用一轮总复习课件(共38份)
2022版高考化学选考山东专用一轮总复习课件:专题七原子结构元素周期表与元素周期律 —应用篇、创新篇
展开
这是一份2022版高考化学选考山东专用一轮总复习课件:专题七原子结构元素周期表与元素周期律 —应用篇、创新篇,共18页。
元素“位—构—性”的关系及应用1.熟记一些具有特殊结构特征的元素前18号元素中:(1)族序数等于周期数的元素:H、Be、Al。(2)族序数等于周期数两倍的元素:C、S。(3)族序数等于周期数三倍的元素:O。(4)周期数等于族序数两倍的元素:Li。(5)周期数等于族序数三倍的元素:Na。(6)ⅠA、ⅢA、ⅦA族→1个未成对电子,ⅣA、ⅥA族→2个未成对电子,
ⅤA族→3个未成对电子(主族元素原子中未成对电子数最多)。(7)在1~36号元素的基态原子中,含未成对电子数最多的为24Cr(价电子排
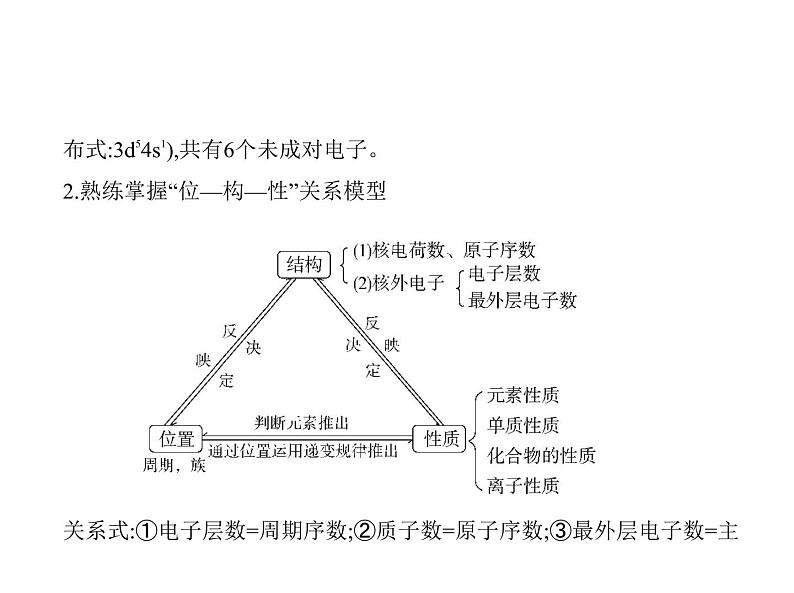
布式:3d54s1),共有6个未成对电子。2.熟练掌握“位—构—性”关系模型 关系式:①电子层数=周期序数;②质子数=原子序数;③最外层电子数=主
族序数;④主族元素的最高正价=主族序数(O、F除外),最低负价=主族序
数-8。3.结构和性质的互推(1)电子层数和最外层电子数决定元素原子的金属性和非金属性;(2)同主族元素最外层电子数相同,化学性质相似;(3)正确推断微粒半径的大小及结构特点;(4)判断元素金属性和非金属性的强弱;(5)熟练掌握常见物质的性质。
点拨 微粒半径比较:①看电子层数,电子层数越多半径越大;②看核电荷
数,电子层数相同核电荷数越小半径越大;③看电子数,核电荷数相同电子
数越多半径越大。非金属性强弱判断:①与氢气化合越容易,非金属性越强;②气态氢化物越
稳定,非金属性越强;③最高价氧化物对应水化物的酸性越强,非金属性越
强;④单质的氧化性越强,非金属性越强。 金属性强弱判断:①金属与水或酸反应置换H2越容易(反应越剧烈),金属
性越强;②最高价氧化物对应水化物的碱性越强,金属性越强;③单质的还
原性越强(对应离子的氧化性越弱),金属性越强。
例 (2020课标Ⅲ,13,6分)W、X、Y、Z为原子序数依次增大的短周期元
素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产
生白烟。下列叙述正确的是( )A.非金属性:W>X>Y>ZB.原子半径:Z>Y>X>WC.元素X的含氧酸均为强酸D.Y的氧化物水化物为强碱
解析 由化合物XW3与WZ相遇会产生白烟,可知XW3和WZ分别是NH3和
HCl,即W是H元素,X是N元素,Z是Cl元素;再根据四种元素的核外电子总
数满足X+Y=W+Z,可知Y是Na元素。A项,Na(Y)是金属元素,其非金属性
不可能大于Cl(Z),错误;B项,原子半径:Na(Y)>Cl(Z),错误;C项,N(X)元素的
含氧酸不全为强酸,如HNO2是弱酸,错误;D项,Na(Y)的氧化物对应的水化
物为NaOH,是强碱,正确。
题目价值 元素周期表、元素周期律是学习化学的工具和基本规律。
元素周期表是元素周期律的具体表现形式,元素周期律是元素周期表排
布的依据。掌握元素的单质及化合物的结构,反应条件,物质的物理、化
学性质等是进行元素及物质推断的关键。
元素推断之未来考查趋势元素推断题主要考查元素周期表中“位—构—性”三者之间的关系及
利用物质结构和性质进行综合推断的能力,体现了证据推理与模型认
知、科学态度与社会责任的核心素养。高考要求“根据图表、数据等
所给背景材料,分析有关现象的变化规律”,此要求常受命题者的青睐。
在元素推断题中,高考考查就有此趋势。从最初单一的元素推断,衍变到
“融合物质转化考查元素推断”“融合元素周期表片段考查元素推
断”“ 融合化学实验考查元素推断”等。为创新命题形式,出现了融合
物质结构考查元素推断的试题,今后的高考考查中,可能会继续延用这种
命题形式,融合物质结构信息、图像信息等,试题题眼常常隐藏于物质结
构或图像信息中,解答此类试题可以采用如下思维模型:
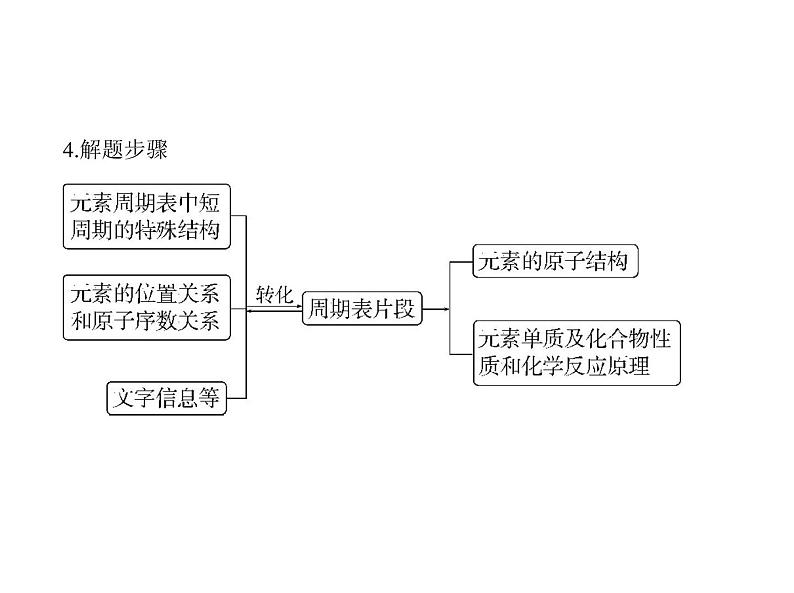
趋势一、融合物质结构考查元素推断融合物质结构的元素推断题,通常在物质结构中隐含解题突破口,首先必
须挖掘物质结构中的信息,在试题中物质结构信息可能以如下形式出现:
物质的结构式、电子式、球棍模型、比例模型、简易晶胞构型、物质
的空间构型等。
例1 (2020课标Ⅱ,13,6分)一种由短周期主族元素组成的化合物(如图所
示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、
且总和为24。下列有关叙述错误的是 ( ) A.该化合物中,W、X、Y之间均为共价键B.Z的单质既能与水反应,也可与甲醇反应C.Y的最高化合价氧化物的水化物为强酸D.X的氟化物XF3中原子均为8电子稳定结构
解题导引 根据解题思维模型,整合信息:题干信息“短周期主族元素”
“元素W、X、Y、Z的原子序数依次增大、且总和为24”;物质结构信
息“W只形成1个共价键”“ Y可形成3个共价键”“Z+为+1价阳离
子”。确定元素:由“W只形成1个共价键”,结合W、X、Y、Z的原子序数依次
增大、且总和为24,确定W为H元素;由“Y可形成3个共价键”,确定Y为
N元素;由“Z+为+1价阳离子”,确定Z为Na元素;由“元素W、X、Y、Z
的原子序数依次增大、且总和为24”,确定X的原子序数=24-11-1-7=5,X
为B元素。
解析 A项,考查共价键形成条件:该化合物中,H、B、N之间均以共用电
子对形成共价键,正确。B项,考查金属钠的性质:Na单质既能与水反应生
成氢氧化钠和氢气,也能与甲醇反应生成甲醇钠和氢气,正确。C项,考查
对“最高价氧化物的水化物概念”的理解:N的最高价氧化物的水化物
为HNO3,是强酸,正确。D项,考查物质中各原子是否达到8电子稳定结构:
B的氟化物BF3中B原子最外层只有6个电子,未达到8电子稳定结构,错
误。
趋势二、融合坐标图像考查元素推断图像题一直都是高考化学中比较常见的一种化学题型,图像是知识最直
观的体现之一,可以通过图像进行推理得出题目中隐含信息。元素推断
题融合图像,利用坐标将化学理论结合数学知识进行考查,更能考查学生
的思维能力,常用的坐标参数有:原子半径、最外层电子数、原子序数、
pH、化合价、溶液或气体体积等。
例2 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应的水化
物分别为甲、乙、丙、丁。常温下甲、丙、丁均可与乙反应生成盐和
水,X、Z、W的原子序数及0.1 ml ·L-1甲、丙、丁溶液的pH如图所示(已
知lg2=0.3)。下列说法正确的是 ( ) A.简单阴离子的还原性:Z
相关课件
这是一份山东专用高考化学一轮复习专题七原子结构元素周期表与元素周期律_基础篇课件,共18页。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题四氧化还原反应 —应用篇,共11页。PPT课件主要包含了实践探究,答案D,答案C等内容,欢迎下载使用。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十九物质的检验、分离与提纯 —应用篇,共6页。









