






所属成套资源:2022版高考化学选考山东专用一轮总复习课件(共38份)
2022版高考化学选考山东专用一轮总复习课件:专题三离子反应 —基础篇
展开
这是一份2022版高考化学选考山东专用一轮总复习课件:专题三离子反应 —基础篇,共18页。PPT课件主要包含了考点清单,离子反应,知能拓展,定量型,顺序型,答案D等内容,欢迎下载使用。
考点一 离子反应与离子共存一、电解质1.概念在① 水溶液 中或熔融状态下能够导电的② 化合物 。2.分类a.强电解质:在水溶液中能够完全电离的电解质,如强酸、强碱、大部分
盐等。b.弱电解质:在水溶液中只能部分电离的电解质,如弱酸、弱碱、水等。3.电离(1)概念:电解质在③ 水溶液里 (或熔融状态下)产生自由移动的④
离子 的过程。
(2)电离的条件:熔融状态(离子化合物)或溶于水(离子化合物和共价化合
物)。(3)表示方法——电离方程式a.强电解质,完全电离,用“ ”连接,如H2SO4 2H++S 。b.弱电解质,部分电离,用“ ”连接,如NH3·H2O N +OH-。4.能导电的物质(1)含有能自由移动的带电微粒(阴、阳离子或电子)的物质能导电,例如:
酸、碱、盐的水溶液,熔融的碱和大多数盐,金属单质,石墨等。(2)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,
不导电的物质不一定是非电解质。
1.概念:有离子参加的反应。2.实质:离子之间的相互反应。3.离子反应发生的条件(1)在水溶液中发生复分解反应的条件1)生成⑤ 沉淀 ,如BaSO4、CaCO3、CuS等;2)生成难电离的物质,如弱酸、弱碱、水等;3)生成⑥ 气体 ,如CO2、H2S等。(2)离子之间发生氧化还原反应的条件强氧化剂转变为弱还原剂,强还原剂转变为弱氧化剂。例如FeCl3溶液中加入Cu,FeCl2溶液中通入Cl2的离子方程式分别为⑦ 2
Fe3++Cu 2Fe2++Cu2+ ,⑧ 2Fe2++Cl2 2Fe3++2Cl- 。
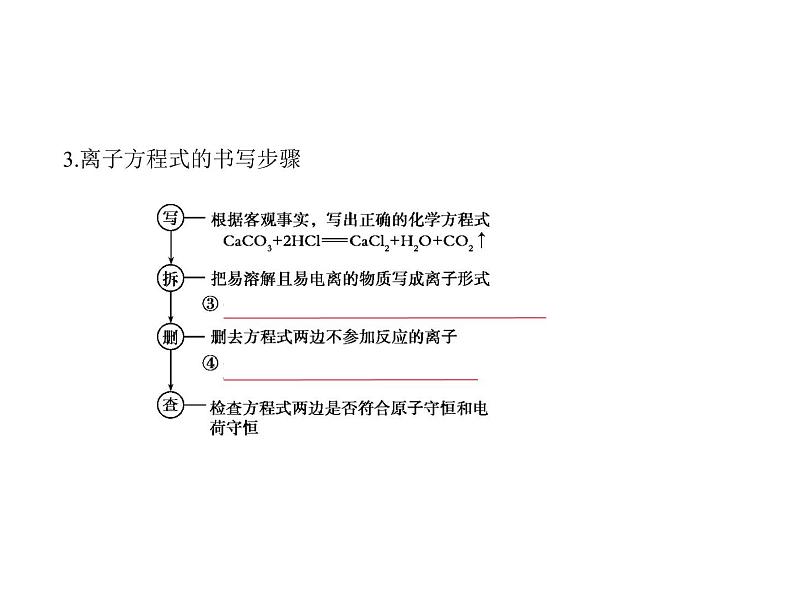
考点二 离子方程式1.定义:用实际参加反应的离子符号表示反应的式子。2.离子方程式书写的关键
3.离子方程式的书写步骤
4.意义不仅可以表示一定物质间的某个反应,而且还可以表示一类化学反应,揭
示这类化学反应的本质,如HCl、HNO3、H2SO4分别与NaOH、KOH溶液
反应的实质为⑤ H++OH- H2O 。5.注意事项(1)书写离子方程式时,浓硫酸不能拆写成离子形式,而浓硝酸、浓盐酸要
拆写成离子形式。(2)多元弱酸的酸式酸根不能拆写成离子形式,如NaHCO3不能拆写成
“Na++H++C ”。(3)离子方程式要遵循原子守恒、电荷守恒,是氧化还原反应的还要遵循
得失电子守恒。
一、涉及量的离子方程式的书写1.过量型①按照组成比例写出不足物质参加反应的离子;②过量物质的离子满足
不足离子需要。如Ca(HCO3)2溶液与过量NaOH溶液反应,离子方程式中
Ca2+与HC 的化学计量数之比一定是1∶2,OH-的化学计量数应满足HC 与OH-完全反应。综合起来可得离子方程式:Ca2++2HC +2OH- CaCO3↓+C +2H2O此类情况也可以总结为以量少的反应物完全反应来判断产物,进而写出
相应的离子方程式。
①按题给条件写出各反应离子的物质的量;②遵循过量离子满足不足离
子的原则。如明矾与等物质的量的Ba(OH)2反应,可设两物质均为1 ml,S
和Al3+过量,可得离子方程式:3Ba2++3S +6OH-+2Al3+ 3BaSO4↓+2Al(OH)3↓3.目标型①根据目标要求按比例写出目标离子符号,如在明矾溶液中加入Ba(OH)2
溶液至Al3+沉淀完全,就要先写出Al3++3OH-;②按组成比例写出与目标离
子结合的其他离子,即2S +Al3++3OH-+3/2Ba2+ 3/2BaSO4↓+Al(OH)3↓+ 1/2S ,整理即可得3S +2Al3++6OH-+3Ba2+ 3BaSO4↓+2Al(OH)3↓,溶液中剩余S 。
反应物滴加顺序不同,离子反应不同,如:把AlCl3溶液逐滴加入NaOH溶液中至过量,先发生反应Al3++4OH- [Al(OH)4]-(或Al3++4OH- Al +2H2O),再发生反应3[Al(OH)4]-+Al3+ 4Al(OH)3↓[或3Al +Al3++6H2O 4Al(OH)3↓]。把NaOH溶液逐滴加入AlCl3溶液中至过量,先发生反应Al3++3OH- Al(OH)3↓,再发生反应Al(OH)3+OH- [Al(OH)4]-[或Al(OH)3+OH- Al +2H2O]。
5.条件型反应条件不同,离子反应不同,如:氯化铵溶液与氢氧化钠溶液混合,离子方程式为N +OH- NH3·H2O。若氯化铵溶液与氢氧化钠溶液混合并加热,则离子方程式为N +OH-
NH3↑+H2O。6.状态型微溶物状态不同,离子反应不同,如:石灰乳与碳酸钠溶液混合,离子方程式为Ca(OH)2+C CaCO3+2OH-。若澄清石灰水与碳酸钠溶液混合,则离子方程式为Ca2++C CaCO3↓。
例1 下列离子方程式正确的是 ( )A.向FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2 2Fe3++Br2+4Cl-B.向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O CaSO3↓+2HClOC.过量氢氧化钙溶液和碳酸氢镁溶液反应:2Ca2++2HC +Mg2++2OH- 2CaCO3↓+MgCO3↓+2H2OD.Na2CO3溶液中通入少量CO2:C +CO2+H2O 2HC
解题导引 离子方程式的书写中涉及“过量或少量”时,将量少的物质
的物质的量看为“1”,量多的按需写。
解析 向FeBr2溶液中通入过量氯气能够将亚铁离子和溴离子都氧化,离子
方程式为2Fe2++4Br-+3Cl2 2Fe3++2Br2+6Cl-,A错误;次氯酸钙溶液具有氧化性,二氧化硫被氧化为硫酸根离子,向Ca(ClO)2溶液中通入少量SO2,离
子方程式为Ca2++3ClO-+SO2+H2O CaSO4↓+2HClO+Cl-,B错误;可将碳酸氢镁的物质的量看做“1”,氢氧化钙的量按需写,则反应的离子方程
式为2Ca2++4OH-+2HC +Mg2+ 2CaCO3↓+Mg(OH)2↓+2H2O,C错误;Na2CO3溶液中通入少量CO2反应生成碳酸氢钠,离子方程式为C +CO2+H2O 2HC ,D正确。
二、离子能否大量共存的判断1.溶液颜色。若限定溶液为无色溶液,则Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+
(浅绿色)、Mn (紫红色)等有色离子不能存在。2.溶液的酸、碱性。在强酸性溶液中,OH-及弱酸根阴离子(如C 、S 、S2-、CH3COO-等)均不能大量存在;在强碱性溶液中,H+及弱碱阳离子(如N 、Al3+、Mg2+、Fe3+等)均不能大量存在;弱酸的酸式酸根离子(如HC 、HS 、HS-、H2P 等)在强酸性和强碱性溶液中均不能大量存在。
3.若离子之间能发生以下反应,则不能在溶液中大量共存。
例2 25 ℃时,下列各组离子在指定溶液中能大量共存的是 ( )A.澄清透明的溶液中:H+、Mg2+ 、S 、Cl-B. =1×10-12的溶液中:K+、Na+、C 、N C.c(Al3+)=0.1 ml/L的溶液中:Na+、N 、OH-、S D.能使甲基橙变红的溶液中:K+、N 、S 、HC
解题导引 先分析附加条件的含义,再分析离子间的相互反应,并注意有
无特殊情况。
相关课件
这是一份山东专用高考化学一轮复习专题三离子反应_基础篇课件,共18页。PPT课件主要包含了考点清单,离子反应,知能拓展,定量型,顺序型,答案D等内容,欢迎下载使用。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题四氧化还原反应 —基础篇,共24页。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十九物质的检验、分离与提纯 —基础篇,共23页。PPT课件主要包含了考点清单,2化学方法,知能拓展,常见阳离子的检验,常见阴离子的检验等内容,欢迎下载使用。








