




所属成套资源:2022版高考化学选考山东专用一轮总复习课件(共38份)
2022版高考化学选考山东专用一轮总复习课件:专题十二化学反应速率和化学平衡 —基础篇
展开
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十二化学反应速率和化学平衡 —基础篇,共18页。
考点一 化学反应速率1.化学反应速率
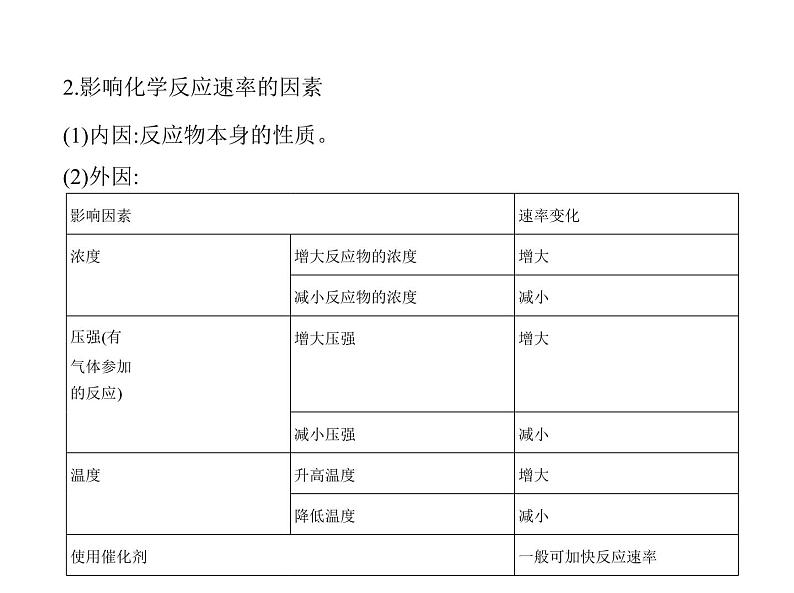
2.影响化学反应速率的因素
(1)内因:反应物本身的性质。(2)外因:
其他影响因素:固体反应物的表面积、超声波、溶剂、放射线辐
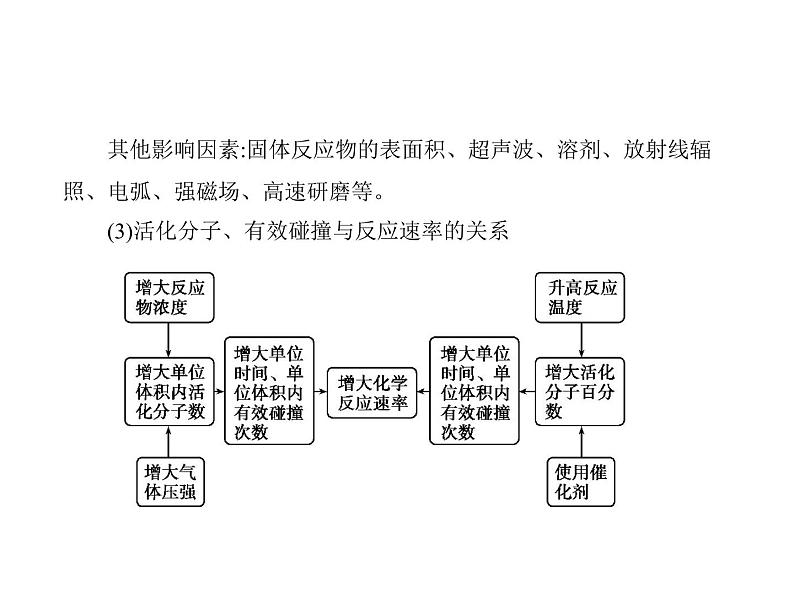
照、电弧、强磁场、高速研磨等。 (3)活化分子、有效碰撞与反应速率的关系
考点二 化学平衡的建立与移动
一、化学平衡1.化学平衡状态在一定条件下的可逆反应里,当正反应速率与逆反应速率① 相等 时,
反应混合物中各组分的浓度② 保持一定 的状态,叫做化学平衡状态,
简称化学平衡。2.化学平衡的特征化学平衡的特征可以概括为“逆”“等”“动”“定”“变”。(1)“逆”:化学平衡的研究对象是可逆反应。(2)“等”:化学平衡的本质是 v(正)=v(逆)≠0。(3)“动”:化学平衡是动态平衡,即处于化学平衡状态时,化学反应并没有
停止,正反应和逆反应仍在进行。
(4)“定”:达到化学平衡状态时,反应混合物中各组分的含量保持恒定。(5)“变”:化学平衡是有条件的,即“定”是相对的、暂时的,而“动”则
是绝对的。当改变影响化学平衡的某一个条件(如温度、压强、浓度)时,
原有的化学平衡状态会被破坏,直至在新的条件下建立新的平衡状态。3.化学平衡移动
点拨 化学反应条件改变,使正、逆反应速率不再相等,化学平衡才会发
生移动。
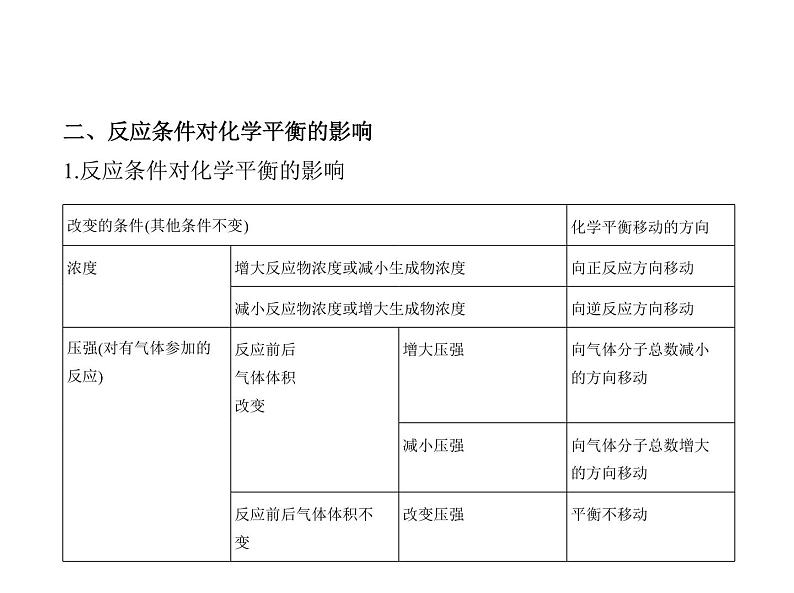
二、反应条件对化学平衡的影响1.反应条件对化学平衡的影响
点拨 压强对化学平衡的影响主要看改变压强能否引起反应物和生成
物的浓度变化,只有引起物质的浓度变化才会造成平衡移动,否则压强对
平衡无影响。 如:惰性气体对化学平衡的影响(1)若容器恒温、恒容,充入惰性气体虽改变了容器内气体的总压强,但却
没有改变各反应气体的浓度,故平衡不移动;(2)若容器恒温、恒压,充入惰性气体就会使容器的容积增大,虽未减小容
器内气体的总压强,但降低了各反应气体的分压和浓度,从而使化学平衡
向气体体积增大的方向移动。
2.化学平衡移动与化学反应速率的关系
三、化学反应进行的方向1.反应焓变与反应方向放热过程中体系能量降低,ΔH液态>固态。(2)熵判据。体系的混乱度增加(即熵增),ΔS>0,反应有自发进行的倾向,但
有些熵减的过程也能自发进行,故熵变只是影响反应方向的一种因素。3.用焓变与熵变综合判断反应方向在等温、等压及除了体积功以外不做其他功的条件下,化学反应的方向
可以用反应的焓变和熵变来综合判断,判据为ΔH-TΔS。
四、勒夏特列原理如果改变影响化学平衡的一个因素,平衡将向着能够减弱这种改变的方
向移动。特别提醒 (1)化学反应速率改变,平衡不一定发生移动,如反应前后气体
体积不变的反应,增大压强或使用催化剂,化学反应速率增大,但平衡不移
动。(2)化学平衡发生移动,化学反应速率一定改变,因为化学平衡移动的根本
原因就是v正≠v逆。(3)压强对平衡的影响很复杂,关键是看压强的改变是否改变了反应体系
中各成分的浓度,只有引起浓度改变才会导致平衡移动,否则就不移动。
考点三 化学平衡常数及化学平衡的有关计算1.平衡常数概念:在一定温度下,当一个可逆反应达到化学平衡时,生成物
浓度幂之积与反应物浓度幂之积的比值是一个常数,用符号K表示。2.平衡常数表达式:对于反应mA(g)+nB(g) pC(g)+qD(g),K= 。
点拨 ①计算K利用的是物质的平衡浓度,而不是任意时刻浓度,也不能
用物质的量;②对于有纯固体和纯液体参加的反应,纯固体、纯液体不列
入平衡常数表达式中;③K只受温度影响,与浓度等无关。3.平衡常数的应用(1)判断可逆反应进行的程度K值越大,说明反应进行的程度越大。
(2)判断化学反应进行的方向对于可逆反应aA(g)+bB(g) cC(g)+dD(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系:Q= ,称为浓度商。
(3)判断可逆反应的热效应 4.平衡转化率和产率平衡转化率是指平衡时已转化了的某反应物的量与转化前该反应物的
量之比,用来表示反应的限度。(1)反应物的转化率= ×100%= ×100%。(2)生成物的产率:实际产量(指生成物)占理论产量的百分数;产率=
相关课件
这是一份2022版高考化学选考山东专用一轮总复习课件:专题四氧化还原反应 —基础篇,共24页。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十九物质的检验、分离与提纯 —基础篇,共23页。PPT课件主要包含了考点清单,2化学方法,知能拓展,常见阳离子的检验,常见阴离子的检验等内容,欢迎下载使用。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十化学能与热能 —基础篇,共14页。PPT课件主要包含了考点清单,知能拓展等内容,欢迎下载使用。








