






所属成套资源:2022版高考化学选考山东专用一轮总复习课件(共38份)
2022版高考化学选考山东专用一轮总复习课件:专题十三弱电解质的电离和溶液的酸碱性 —基础篇
展开
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十三弱电解质的电离和溶液的酸碱性 —基础篇,共31页。
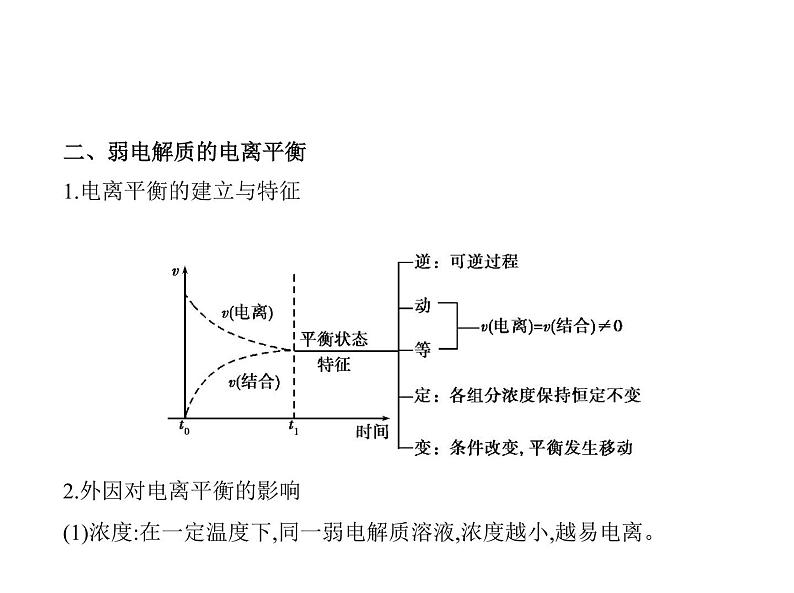
考点一 弱电解质的电离平衡
一、强电解质和弱电解质1.定义及分类 2.电解质强弱的判断方法(1)在相同浓度、相同温度下,比较反应速率的快慢。如将锌粒投入到等
浓度的盐酸和醋酸溶液中,起始速率前者比后者快,说明醋酸是弱电解
质。
(2)比较浓度与pH的关系。如0.1 ml·L-1的CH3COOH溶液,其pH>1,则可证
明CH3COOH是弱电解质。
(3)测定对应盐的酸碱性。如CH3COONa溶液呈碱性,则证明醋酸是弱
酸。(4)比较稀释前后的pH变化与稀释倍数的关系。如将pH=2的酸溶液稀释
至原体积的1 000倍,若2HF>CH3
COOH>H2CO3>H2S>HClO。2.电离常数的影响因素(1)电离常数随温度的变化而变化,但由于电离过程的热效应较小,温度改
变对电离常数影响不大,其数量级一般不变,所以室温范围内可忽略温度
对电离常数的影响。(2)电离常数与弱酸、弱碱的浓度无关,同一温度下,不论弱酸、弱碱的浓
度如何变化,电离常数是不会改变的。3.多元弱酸溶液中的离子浓度关系25 ℃时,H3PO4分三步电离,第一步最强(K1=7.1×10-3),第二步较弱(K2=6.3×
10-8),第三步最弱(K3=4.2×10-13)。c(H+)>c(H2P )>c(HP )>c(P )>c(OH-)H2S分两步电离,第一步强(K1=1.3×10-7),第二步弱(K2=7.1×10-15)。c(H+)>c(HS-)>c(OH-)>c(S2-)
点拨 一般K1≫K2≫K3,即第二步电离通常比第一步电离难得多,第三步
电离又比第二步电离难得多。因此计算多元弱酸溶液中的c(H+)或比较
弱酸酸性相对强弱时,通常只考虑第一步电离。
考点二 溶液的酸碱性 酸碱中和滴定
一、水的电离平衡1.水的电离平衡水是一种极弱的电解质,存在电离平衡:① H2O H++OH- (ΔH>0),
KW=c(H+)·c(OH-),室温下,KW=1×10-14。KW只与温度有关,水的电离是吸热
过程,升高温度,KW② 增大 。KW不仅适用于纯水,也适用于稀的电解
质水溶液。在任何水溶液中均存在H+和OH-,只要温度不变,KW就不变。2.水的电离平衡的影响因素(1)酸、碱:抑制水的电离。(2)温度:温度升高,促进水的电离;温度降低,抑制水的电离。(3)能水解的盐:促进水的电离。(4)其他:如加入钠促进水的电离等。
点拨 对水加热,水的电离程度增大,pH减小,但水中c(H+)=c(OH-),仍显中
性。
二、溶液的酸碱性和pH1.溶液的酸碱性溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。(1)c(H+)③ > c(OH-),溶液呈酸性;(2)c(H+)=c(OH-),溶液呈中性;(3)c(H+)④ c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)D.c点溶液中,c(H+)-c(OH)=c( )+c(NH3·H2O)
解题导引 中和滴定曲线“四点分析”起点——定酸(或碱)的强弱及电离常数的计算;中间点——盐和弱电解质相等,分析三大守恒;中和点——恰好完全反应点,溶质只有盐;中性点——分析电荷守恒。
相关课件
这是一份山东专用高考化学一轮复习专题十三弱电解质的电离和溶液的酸碱性_基础篇课件,共31页。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十五有机物的分类、组成和结构 —基础篇,共34页。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十四盐类水解和沉淀溶解平衡 —基础篇,共21页。








