





所属成套资源:2022高考化学人教版一轮复习课件(共36份)
2022高考化学人教版一轮复习课件:选修3 第1节 原子结构与性质
展开
这是一份2022高考化学人教版一轮复习课件:选修3 第1节 原子结构与性质,共60页。PPT课件主要包含了必备知识自主预诊,关键能力考向突破,答案C等内容,欢迎下载使用。
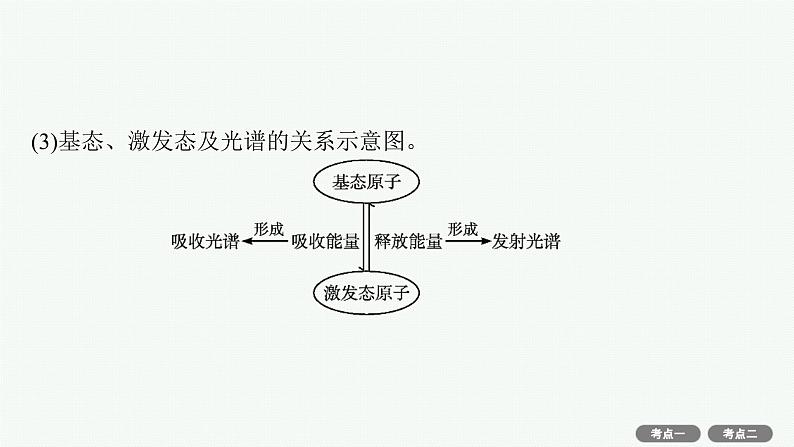
知识梳理1.能层与能级(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。通常用K、L、M、N……表示,能量依次升高。(2)能级:同一能层里电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示。同一能层里,各能级的能量按s、p、d、f的顺序依次升高,即:E(ns)I1(B)>I1(Li)。(2)①Zn位于第四周期第ⅡB族,属于ds区,Zn的核外电子排布为[Ar]3d104s2。②根据洪特规则特例进行判断,锌失去一个电子的价电子层变化为3d104s2→3d104s1,铜失去一个电子的价电子层变化为3d104s1→3d104s0,锌由稳定的全充满结构变为较稳定的半充满结构,而铜为较稳定的4s1半充满结构变为较稳定的4s0全空结构,故Zn的第一电离能比Cu的第一电离能大。
(3)从题图可以看出:除N外,第二周期元素随核电荷数依次增大,E1逐渐增大,这是因为随原子半径逐渐减小,元素非金属性增强,得电子能力增强;氮原子的2p轨道处于半充满状态,不易再结合一个电子,故E1呈现异常。(4)O是非金属元素,而Mn是金属元素,O易得电子而不易失电子,所以O的第一电离能大于Mn的。
归纳总结 电离能的四大应用(1)判断元素金属性的强弱。电离能越小,金属越容易失去电子,金属性越强;反之越弱。(2)判断元素的化合价。I1、I2……表示各级电离能。如果某元素的In+1≫In,则该元素的常见化合价为+n价。如钠元素I2≫I1,所以钠元素的化合价为+1价。
(3)判断核外电子的分层排布情况。多电子原子的各级电离能逐级增大,有一定的规律性。当电离能的变化出现突跃时,电子层数就可能发生变化。(4)反映元素原子的核外电子排布特点。同周期元素从左向右,元素的第一电离能并不是逐渐增大的,当元素的核外电子排布是全空、半充满或全充满状态时,第一电离能就会反常的大。
对点演练1(2021湖北天门质检)X、Y是同周期的两种主族元素,它们的逐级电离能(I)数据如下表所示:
下列有关说法正确的是 。 ①电负性:XS>Si,电负性:S>P>Si。(4)d元素基态原子的电子排布图为 ,i元素为Ga,电子排布式为1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1。
归纳总结 正确表述元素周期律
相关课件
这是一份人教版高考化学一轮复习11.1原子结构与性质课件
这是一份2022届高考化学(人教版)一轮总复习课件:第30讲 原子结构与性质,共60页。PPT课件主要包含了高考备考导航,考点一原子结构,核心知识梳理,pdf,核外经常出现,能量低,能量较高,最低状态,最低能量,低能级等内容,欢迎下载使用。
这是一份2022高考化学人教版一轮复习课件:选修3 第2节 分子结构与性质,共60页。PPT课件主要包含了必备知识自主预诊,共价键的分类,关键能力考向突破,答案A,形成条件,答案B,网络构建,核心速记等内容,欢迎下载使用。








