






2022届高考化学(人教版)一轮总复习课件:第3讲 物质的组成、性质和分类
展开第3讲 物质的组成、性质和分类
考试要求:1.了解分子、原子、离子和原子团等的概念。2.理解物理变化与化学变化的区别与联系。3.理解混合物和纯净物、单质和化合物、金属和非金属的概念。4.理解酸、碱、盐、氧化物的概念及相互联系。5.了解胶体是一种常见的分散系,了解溶液和胶体的区别
名师点拨:1.本讲知识比较零碎,容易混淆,在复习时,要注意关键字的理解和记忆、一般中的特殊情况等,解题时可采用“概念对比法”或“反例否定法”等方法解决问题。2.虽然知识相对简单,却是考试中最容易失分的地方。可采取如下方法突破:见到题中最爱挖坑的关键词先想可能挖的坑是什么,题中是不是有坑等着我跳,要是让我设计这道题我在哪挖坑等。当然,这是建立在基础打牢,多刷题、多进行类似思考的前提下才能实现的。
3.物质的组成、分类、性质与变化等都属于基本概念的范畴,在高考卷中单独考查的概率很小。预计2022年全国高考将以选择题的形式考查,考查方向主要有两个:一是对物质的分类与分类方法的考查,主要考查物质的分类是否正确、物理变化和化学变化的区别及判定等,更多是考查对物质成分的了解;二是对胶体知识的考查,命题以重要的新闻背景、新科技等为题材考查胶体的特性、Fe(OH)3胶体制备及胶体知识在生活中的应用等。
考点一 物质的组成、性质与分类
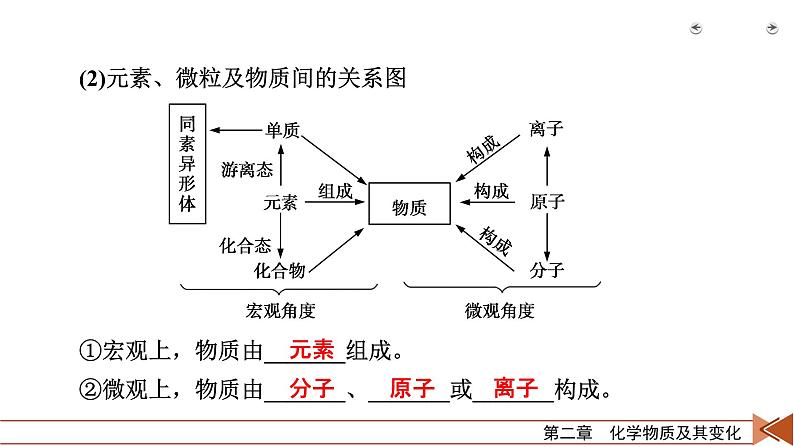
1.元素、物质及微粒(1)元素的存在形态:①游离态:元素以_______形式存在的状态。②化合态:元素以___________形式存在的状态。
(2)元素、微粒及物质间的关系图①宏观上,物质由_______组成。②微观上,物质由_______、_______或_______构成。
2.物质的分类(1)分类的定义:把事物按照___________________进行归类分组的一种方法。(2)物质的分类方法①交叉分类法。根据不同的分类标准对同一事物进行分类的一种分类方法。如:
②树状分类法简单地说,是将被分类对象按照从属关系逐级进行(不同层次)分类的一种分类方法,其陈列式的形状像树。A.明确分类标准是对物质正确树状分类的关键
B.树状分类法在无机化合物分类中的应用
(1)把握物质分类的2个“误区”①误认为溶液呈酸性的物质一定是酸,溶液呈碱性的物质一定是碱。②误认为能与酸反应生成盐和水的氧化物就是碱性氧化物,如Na2O2不属于碱性氧化物。(2)物质分类中的一些特例①只含一种元素的物质不一定是纯净物,如O2和O3组成的混合气体,金刚石和石墨等。
②由不同同位素构成的单质(或化合物)是纯净物,如H2和D2、H2O和D2O,由12C和13C组成的石墨也是纯净物。③冰水混合物、结晶水合物(如CuSO4·5H2O)属于纯净物而不是混合物;高分子化合物(如聚乙烯CH2—CH2)属于混合物而不是纯净物。
3.物质的性质与变化(1)化学变化:宏观上有___________生成,微观上有旧化学键的_______和新化学键的_______。
(2)常见的物理变化、化学变化
4.单质、氧化物、酸、碱和盐的转化关系(1)转化示意图
(2)实例:请写出①②③④⑦的化学方程式,并注明反应类型:①___________________,____________;②______________________,__________;
③________________________________________,_____________;④__________________________,____________;⑦______________________________________;_______________思考:金属和盐反应时,是否一定生成金属和盐?请举例说明。提示:不一定。如Fe+2FeCl3===3FeCl2、Cu+2FeCl3===CuCl2+2FeCl2。
2Ca+O2===2CaO
CaO+H2O===Ca(OH)2
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
Fe+2HCl===FeCl2+H2↑
CaCO3+2HCl===CaCl2+H2O+CO2↑
1.判断正误,正确的打“√”,错误的打“×”。(1)只含一种元素的物质一定是纯净物,只用同一化学式表示的物质也一定是纯净物。( )(2)与水反应可生成酸的氧化物都是酸性氧化物。( )(3)既能与酸反应又能与碱反应的物质是两性氧化物或是两性氢氧化物。( )(4)非金属氧化物不一定是酸性氧化物,金属氧化物不一定是碱性氧化物。( )
(5)溶于水呈酸性的物质是酸,呈碱性的物质是碱。( )(6)HCOOH含有两个氢,所以是二元酸。( )(7)盐一定由金属离子和酸根离子组成。( )(8)煤的气化、液化、干馏都是物理变化。( )(9)臭氧变成氧气是物理变化。( )(10)冰水混合物属于化合物,高分子化合物属于混合物。( )(11)胆矾(CuSO4·5H2O)、明矾[ KAl(SO4)2·12H2O]属于混合物。( )(12)NaHSO4、NaHCO3都属于酸式盐,溶液都呈酸性。( )
(13)含氧元素的化合物必定是氧化物。( )(14)SiO2既能与NaOH溶液反应又能与氢氟酸反应,因此是两性氧化物。( )(15)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱。 ( )
3.深度思考:无机化合物可根据其组成和性质进行分类:(1)如图所示的物质分类方法名称是____________。(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
(3)写出⑦转化为⑤的化学方程式_____________________________。(4)呼吸面具中用⑧作为O2来源的反应原理为:____________________________________________,___________________________________________。(5)实验室制备⑦常用_________和___________反应,检验该气体的方法是_____________________________________________________。
CO2+2NaOH===Na2CO3+H2O
2Na2O2+2CO2===2Na2CO3+O2
2Na2O2+2H2O===4NaOH+O2↑
通入澄清石灰水中,若变浑浊,则生成的气体为CO2
(1)(2021·经典习题选萃)“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( )A.蚕丝的主要成分是蛋白质B.蚕丝属于天然高分子材料C.“蜡炬成灰”过程中发生了氧化反应D.古代的蜡是高级脂肪酸酯,属于高分子聚合物
微考点1 物质分类与性质
[解析] A项,蚕丝的主要成分是蛋白质,蛋白质属于天然高分子化合物,蚕丝属于天然高分子材料,A、B两项正确;“蜡炬成灰”过程中发生了燃烧反应,燃烧反应属于氧化反应,C项正确;古代的蜡烛多是由动物油脂制造,动物油脂属于高级脂肪酸酯,但高级脂肪酸酯不属于高分子聚合物,D项错误,故选D。
萃取精华:同一种物质,按不同的标准进行分类,可得到不同的分类结果,如Na2CO3属于钠盐、碳酸盐、含氧酸盐、正盐等。因此,对物质进行分类时,必须指明分类的标准。溶于水生成酸的氧化物不一定是酸性氧化物,如NO2;溶于水生成碱的氧化物不一定是碱性氧化物,如Na2O2。液氯、液氨、冰水混合物、结晶水合物等都属于纯净物。
[解析] 含有两种或两种以上成分的物质属于混合物,A项物质由两种单质组成,故属于混合物。
〔对点集训1〕 (1)(2020·课标Ⅰ,7)国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是( )A.CH3CH2OH能与水互溶B.NaClO通过氧化灭活病毒C.过氧乙酸相对分子质量为76D.氯仿的化学名称是四氯化碳
[解析] A项,乙醇可与水以任意比互溶,正确;B项,NaClO水解生成的HClO具有强氧化性,可通过氧化灭活病毒,正确;C项,过氧乙酸的分子式为C2H4O3,其相对分子质量为76,正确;D项,氯仿的分子式是CHCl3,其化学名称是三氯甲烷,错误。
(2)(2020·课标Ⅱ,7)北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是( )A.胆矾的化学式为CuSO4B.胆矾可作为湿法冶铜的原料C.“熬之则成胆矾”是浓缩结晶过程D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应
[解析] A项,胆矾是硫酸铜晶体,其化学式为CuSO4·5H2O,错误;B项,湿法冶铜中的一步反应是铁与CuSO4溶液发生置换反应,故胆矾可作为湿法冶铜的原料,正确;C项,将CuSO4溶液蒸发浓缩,再冷却结晶可得胆矾,正确;D项,铁与硫酸铜溶液发生置换反应,置换出来的铜附在铁釜上,正确。
[解析] 将Cl2通入石灰乳中才能制得漂白粉,A项不正确;先将氨气通入饱和食盐水,再通入CO2反应才能制得NaHCO3晶体,B项不正确;氧化性Cl2>Br2>I2,故可以发生反应Cl2+2NaBr===Br2+2NaCl、Br2+2NaI===I2+2NaBr,C项正确;电解MgCl2溶液只能得到Mg(OH)2,不能得到Mg单质,D项不正确。
萃取精华:物质间转化的5个常见易错点S燃烧不能直接生成SO3而是生成SO2。Al2O3、SiO2、Fe2O3与H2O不反应,不能直接转化为Al(OH)3、H2SiO3、Fe(OH)3。NH3催化氧化不能直接生成NO2。Fe与Cl2反应不能直接生成FeCl2。Fe与H+、Cu2+、S、I2反应不能直接生成Fe3+。
〔对点集训2〕 (1)(2021·山东滨州高三检测)已知A是单质,E有强酸性和强氧化性。A、B、C、D,E是含有一种相同元素的五种物质,在一定条件下可发生如图所示的变化。则A可能是( ) A.Cl2B.C C.N2 D.Si
[解析] 根据转化关系可知,A应是非金属单质,A能被氧气氧化生成C,C能被氧化生成D,则A在氧化物中显不同价态,E有强酸性和强氧化性,则A中元素是非金属性较强的元素。氯气和氢气反应生成氯化氢,氯化氢和氧气不反应,A项错误;碳和氧气反应生成一氧化碳,CO和O2反应生成二氧化碳,CO2和H2O反应生成碳酸,但碳酸是弱酸,B项错误;N2和H2反应生成NH3,NH3和O2反应生成一氧化氮,氮气和氧气反应生成一氧化氮,NO和O2反应生成NO2,NO2和H2O反应生成硝酸,硝酸是强酸且具有强氧化性,C项正确;硅和氧气反应时,无论氧气是否过量都生成SiO2,且SiO2与H2O不反应且硅酸是弱酸,D项错误。
(2)(2021·山东滨州高三检测)下列说法在一定条件下可以实现的是( )①酸性氧化物与碱发生反应②弱酸与盐溶液反应可以生成强酸③没有水生成,也没有沉淀和气体生成的复分解反应④两种酸溶液充分反应后的溶液体系为中性⑤有单质参加的非氧化还原反应⑥两种氧化物反应的产物有气体A.①②③④⑤⑥ B.②④⑤⑥C.①②③⑤D.③④⑤⑥
[易错警示] 常考易错的几个物质的转化(1)结晶水合物失去结晶水的过程属于化学变化。(2)浓硫酸的吸水性属于物理性质,脱水性属于化学性质。(3)煤的干馏、煤的气化以及煤的液化都属于化学变化,石油的分馏属于物理变化,石油的裂化和裂解都属于化学变化。(4)同素异形体之间的转化属于化学变化。
萃取精华:正确理解“一定”“不一定”,规避概念失分点①碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物)。②酸性氧化物不一定是非金属氧化物(如Mn2O7是酸性氧化物);非金属氧化物也不一定是酸性氧化物(如CO、NO都不是酸性氧化物)。③酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、Fe2O3都不与水反应)。
④胆矾、明矾等结晶水合物是纯净物。⑤与水反应生成酸的氧化物不一定是酸性氧化物(如NO2不是酸性氧化物);与水反应生成碱的氧化物不一定是碱性氧化物(如Na2O2不是碱性氧化物)。⑥确定某酸是几元酸,不能依据分子中氢原子的个数,如CH3COOH不是四元酸,而是一元酸。
常见混合物①分散系(如溶液、胶体、浊液等);②高分子(如蛋白质、纤维素、聚合物、淀粉等);③常见特殊名称的混合物,如石油、石油的各种馏分、煤、漂白粉、碱石灰、福尔马林、油脂、天然气、水煤气、铝热剂、氨水、氯水、王水等。④分子式为C5H10的物质可能是纯净物也可能是混合物。
1.分散系(1)定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。分散质:分散系中___________的物质;分散剂:分散系中_____________的物质。
(2)分类①把分散系分为溶液、胶体和浊液的标准是分散质________________。可用如下方式直观地表示:
②若按分散质、分散剂的状态分类,可分为9种分散系,如图:如烟属于_______分散系;雾属于_______分散系;悬浊液属于_______分散系;合金属于_______分散系。
2.胶体(1)胶体的分类①依据分散剂的状态:气溶胶:如_____________液溶胶:如_____水溶胶固溶胶:如烟水晶、________玻璃②依据分散质粒子的大小:粒子胶体:如Fe(OH)3胶体;分子胶体:如淀粉溶液、蛋白质溶液。
(2)胶体的性质与应用
[微点拨] (1)丁达尔效应是物理变化而不是化学变化。(2)胶体不带电,胶体中的胶粒能够吸附体系中的带电粒子而使胶粒带电荷,但整个分散系仍呈电中性。
[微点拨] (1)不能用自来水制备Fe(OH)3胶体,因为自来水中有电解质会使胶体发生聚沉,应用蒸馏水。(2)不能过度加热,否则Fe(OH)3胶体会聚沉生成Fe(OH)3沉淀。(3)书写制备胶体的化学方程式时,生成的胶体不加沉淀符号“↓”,应注明“胶体”二字。(4)Fe(OH)3胶体粒子是多个“Fe(OH)3”的集合体,因此,1 ml Fe3+完全水解得到Fe(OH)3胶体粒子数小于NA。
4.理清三种分散系的差异
[微点拨] (1)胶体区别于其他分散系的本质特征是胶体粒子的直径在1~100 nm(即10-9~10-7m)之间,而不是丁达尔效应。(2)胶体具有介稳性的主要原因是胶体粒子可以通过吸附带电粒子而带有电荷,且同种电荷相互排斥,不易聚集成较大的颗粒。(3)胶体粒子的直径决定了胶体的性质,因胶体粒子较大不能透过半透膜,可用渗析法提纯胶体。
1.判断正误,正确的打“√”,错误的打“×”。(1)稀豆浆、硅酸、氯化铁溶液均为胶体。( )(2)明矾溶于水产生Al(OH)3胶体:Al3++3H2O===Al(OH)3↓+3H+。 ( )(3)丁达尔效应是胶体与溶液的本质区别。( )(4)含0.1 ml FeCl3的饱和溶液配制成胶体后,将得到胶体粒子0.1 ml。( )(5)FeCl3溶液和Fe(OH)3胶体都呈红褐色。( )
(6)可用过滤的方法将胶体粒子与分散剂分开。( )(7)沸水中滴加少量饱和FeCl3溶液形成带电的胶体,导电能力增强。( )(8)通过丁达尔效应可以鉴别稀豆浆和氢氧化铁胶体。( )[提示] 稀豆浆属于胶体。(9)明矾净水时发生了化学及物理变化,能起到杀菌、消毒作用。( )[提示] 明矾净水只是把浑水变为清水,无杀菌消毒的作用,错误。
(10)按照分散质和分散剂所处的状态,可分为9种分散系。( )(11)胶体的丁达尔效应是发生了化学变化。( )(12)为除去淀粉溶液中混有的NaCl,可以采取渗析的方法。( )(13)将Fe(OH)3胶体装入U形管,两端通直流电,与直流电源负极相连的一极颜色变深。( )(14)胶体不一定是液态,胶体的丁达尔效应属于物理变化。( )(15)将1 mL 1 ml·L-1的FeCl3溶液滴入沸水中制备Fe(OH)3胶体,若FeCl3完全水解,则可制得Fe(OH)3胶体粒子少于0.001NA个。( )
2.深度思考:(1)向Fe(OH)3胶体中滴入过量稀硫酸,现象是什么?其原因是什么?(2)胶体与其他分散系的本质区别是什么?怎样提纯胶体?
[提示] (1)先出现红褐色沉淀,后沉淀溶解。开始加入稀硫酸时,胶体发生聚沉生成氢氧化铁沉淀,当酸过量时发生酸碱中和反应沉淀又溶解。(2)胶体粒子的直径在1~100 nm之间,这是胶体区别于其他分散系的本质特征,同时也决定了胶体的性质。由于胶体粒子较大不能透过半透膜,而离子、分子较小可以透过半透膜,可用渗析法将胶体粒子和溶液中的离子、分子分开。
(2021·浙江金华调研)下列关于胶体的说法,正确的是( )A.“霾尘积聚难见路人”,雾霾所形成的气溶胶没有丁达尔效应B.工厂静电除尘装置利用了胶体的电泳原理C.将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体D.将植物油倒入水中用力搅拌可得到胶体分散系
微考点1 胶体的性质与用途
[解析] 雾霾所形成的气溶胶属于胶体,胶体能够产生丁达尔效应,所以雾霾所形成的气溶胶可以产生丁达尔效应,A错误;胶体中的胶粒带电,故可以在电场中向着某一极移动,可以用于工厂除尘,B正确;将NaOH浓溶液滴加到饱和FeCl3溶液中得到Fe(OH)3沉淀,C错误;将植物油倒入水中用力搅拌,可得到乳浊液,D错误。
[易错警示] (1)区分胶体和其他分散系的本质特征是胶体粒子直径介于1~100 nm之间;区分胶体和溶液的常用方法是丁达尔效应。(2)胶体粒子的直径决定了胶体的性质,因胶体粒子较大不能透过半透膜,可用渗析法提纯胶体。(3)胶体不带电荷,胶体粒子(分散质)可能带电荷,但淀粉胶体的胶体粒子不带电荷。(4)胶体属于分散系,是混合物,而很多纳米级物质的微粒直径也是在1~100 nm之间,但不属于胶体,因为这些物质属于纯净物,如纳米铜等。(5)在Fe(OH)3胶体中,Fe(OH)3胶体粒子的数目要远远小于原FeCl3溶液中Fe3+的数目。
〔对点集训1〕 (2021·山东潍坊高三检测)下列关于胶体的说法正确的是( )①蔗糖溶液、淀粉溶液属于溶液,烟、雾属于胶体②溶液和胶体的本质区别是后者具有丁达尔效应,而前者无此现象③制备Fe(OH)3胶体的方法是将饱和FeCl3溶液滴加到沸水中煮沸至液体呈红褐色④利用过滤的方法能将Fe(OH)3胶体从FeCl3溶液中分离出来⑤由肾功能衰竭等疾病引起的血液中毒,可利用“血液透析”进行治疗
⑥水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染,该过程利用了胶体的电泳现象⑦葡萄糖注射液能产生丁达尔效应,属于胶体⑧溶液是电中性的,胶体是带电的⑨清晨,在茂密的树林中,常常可以看到从树叶间透过的一道道光柱,该现象与胶体的性质有关A.①②④⑥ B.③⑤⑥⑨C.③⑤⑦⑧D.②③⑥⑨
[答案] B[解析] ①淀粉溶液属于胶体,错误;②溶液和胶体的本质区别是分散质粒子直径的大小,错误;④胶体与溶液都能透过滤纸,不能用过滤的方法分离两者,错误;⑤“血液透析”的原理是渗析,正确;⑦葡萄糖是小分子,溶于水形成溶液,错误;⑧胶体是电中性的,胶体中胶粒表面积较大,吸附溶液中的离子使胶体粒子带电荷,错误。综上所述,B正确。
微考点2 胶体的制备及鉴别、分离
[解析] 过滤法可分离固体和液体,故A错误;X是FeCl3溶液,分散质是Cl-和Fe3+,Z是Fe(OH)3胶体,分散质是Fe(OH)3胶粒,故B正确;CaCO3能与H+结合生成H2O和CO2,促进Fe3+的水解,故C正确;Z是Fe(OH)3胶体具有胶体的性质,能产生丁达尔效应,故D正确。
萃取精华:胶体与溶液的分离和鉴别鉴别:利用丁达尔效应鉴别胶体和溶液。分离:利用渗析操作来分离胶体和溶液。
〔对点集训2〕 (1)(2021·山东青岛高三检测)向含有c(FeCl3)=0.2 ml·L-1、c(FeCl2)=0.1 ml·L-1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其分散质粒子是直径约为9.3 nm的金属氧化物,下列有关说法中正确的是( )A.该分散系的分散质为Fe2O3B.该分散系属于溶液C.加入NaOH时发生的反应可能为Fe2++2Fe3++8OH-===Fe3O4+4H2OD.可用过滤的方法将黑色金属氧化物与Na+分离开
[解析] 本题考查从宏观角度辨识不同的分散系,从微观角度探析不同分散系性质的成因。氧化铁为红棕色,由题意知得到一种黑色分散系,A项错误;该分散系中分散质粒子是直径约为9.3 nm的金属氧化物,则该分散系为胶体,B项错误;氯化亚铁、氯化铁与氢氧化钠反应生成四氧化三铁、水和氯化钠,离子方程式为Fe2++2Fe3++8OH-===Fe3O4+4H2O,C项正确;胶体、溶液都可以透过滤纸,不能用过滤方法分离,D项错误。
(2)(2021·经典习题选萃)下列有关胶体制备及应用的叙述正确的有__________(填序号)。①将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体②在某FeCl3饱和溶液中含有1 ml FeCl3,制得的胶体中Fe(OH)3胶粒数目小于NA③Fe2(SO4)3可用作净水剂的原因是由于Fe2(SO4)3易溶于水④明矾水解时产生具有吸附性的胶体粒子,可作漂白剂⑤在实验中不慎被玻璃划破手指,可用FeCl3溶液应急止血⑥由肾功能衰竭等疾病引起的血液中毒,可利用“血液透析”进行治疗⑦水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
[解析] 将NaOH浓溶液滴加到饱和FeCl3溶液中,生成红褐色的Fe(OH)3沉淀而不是胶体,故①错误。Fe(OH)3胶体粒子是许多Fe(OH)3分子的集合体,因此在Fe(OH)3胶体中,Fe(OH)3胶体粒子数要远小于原FeCl3溶液中Fe3+的数目,故②正确。可溶性铝盐或铁盐,如Fe2(SO4)3在水溶液中形成Fe(OH)3胶体而起到净水作用,并不是因为Fe2(SO4)3易溶于水,故③错误。明矾溶于水电离出的Al3+水解生成氢氧化铝胶体,胶体具有吸附性,因此明矾可以吸附水中的小颗粒悬浮杂质而起到净水作用,但不能用作漂白剂,故④错误。
血液是胶体,FeCl3溶液是电解质溶液,在胶体中加入电解质会使胶粒聚沉,因此FeCl3可以使血液中的胶粒聚沉而止血,故⑤正确。血液透析的原理类似于渗析原理,血液是胶体,透析膜相当于半透膜的作用,肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗,故⑥正确。工厂烟尘属于气溶胶,用高压直流电除去工厂烟尘应用了胶体的电泳性质,故⑦正确。
[误区警示] 胶体知识易错“4”提醒
(3)(2021·广东高三检测)近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚,杀菌于一体的新型高效多功能水处理剂。干燥的高铁酸钾受热易分解,但在198 ℃以下是稳定的。高铁酸钾在水处理过程中涉及的变化过程有( )①胶体的吸附 ②盐类水解③焰色反应 ④氧化还原反应A.①②③④ B.①②④C.②③④D.①③④
[解析] K2FeO4具有强氧化性,能杀菌消毒。FeO的还原产物是Fe3+,Fe3+水解生成Fe(OH)3胶体,胶体具有很强的吸附性,故能起到净化水的作用。因此,K2FeO4在水处理过程中涉及了①②④的变化过程。
(4)(2021·河北衡水检测)某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。①该小组同学采用了以下操作制备胶体,请将空白处填写完整。取一个烧杯,加入20 mL蒸馏水,加热至沸腾,然后向烧杯中滴加1~2 mL饱和_________溶液,继续煮沸,待______________后,停止加热。②将制得的胶体放入半透膜制成的袋内,如图甲所示,放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察_____(填“有”或“无”)丁达尔效应,再向烧杯中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为___________________。
③将半透膜内的液体倒入U形管中,如图乙所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是_____(填“阴”或“阳”)极附近颜色逐渐变深,其原因是____________________________。
Fe(OH)3胶体粒子带正电荷
[解析] ①制备氢氧化铁胶体应该将新制的饱和氯化铁溶液滴入沸水中,继续煮沸至液体呈红褐色,停止加热。②胶体不能透过半透膜,而溶液中的离子能透过半透膜,所以半透膜外的液体不能产生丁达尔效应,由于溶液中含有Cl-,因此能和Ag+反应生成不溶于稀硝酸的氯化银白色沉淀。③氢氧化铁胶体的胶粒带正电荷,通电时向阴极移动,故阴极附近溶液颜色加深。
萃取精华:胶体聚沉属于物理变化。如蛋白质的盐析就属于胶体聚沉现象,但蛋白质的变性不属于胶体的聚沉,此过程属于化学变化。胶体能稳定存在的主要原因是胶体粒子带有电荷,同种电荷相互排斥不易聚集成较大的颗粒。不是所有胶体都有电泳现象,如淀粉胶体粒子不带电荷。有电泳现象的胶体是因为胶粒吸附带电荷的粒子而带电。
书写Fe(OH)3胶体制备的化学方程式的四个易错点:①用“===”而不是“”;②Fe(OH)3后不标“↓”;③反应条件是“Δ”;④HCl后不能标“↑”符号。
本讲要点速记:1.牢记1个范围:胶体分散质粒子直径在1~100 nm。2.熟知2种分类方法:交叉分类法和树状分类法。3.明确3种分散系及本质区别:溶液、浊液和胶体,本质区别是分散质粒子直径的大小。4.胶体的3性质:丁达尔效应、聚沉和电泳。5.聚沉3方法:加入电解质溶液、加热或搅拌、与胶粒带相反电荷的胶体混合。
第04讲 物质的组成、性质和分类(课件)-备战2024年高考化学一轮复习讲练测: 这是一份第04讲 物质的组成、性质和分类(课件)-备战2024年高考化学一轮复习讲练测,共60页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。
新高考化学一轮复习课件 第1章 第1讲 物质的组成、性质和分类: 这是一份新高考化学一轮复习课件 第1章 第1讲 物质的组成、性质和分类,共60页。PPT课件主要包含了高考化学一轮复习策略,物质的组成与分类,归纳整合,专项突破,物质的性质与变化,分散系胶体,真题演练明确考向,课时精练等内容,欢迎下载使用。
(新高考)高考化学大一轮复习课件第1章第1讲物质的组成、性质和分类(含解析): 这是一份(新高考)高考化学大一轮复习课件第1章第1讲物质的组成、性质和分类(含解析),共60页。PPT课件主要包含了复习目标,物质的组成与分类,物质的组成1,不同种单质,金属氧化物,碱性氧化物,两性氧化物,非金属氧化物,酸性氧化物,不成盐氧化物等内容,欢迎下载使用。












