

初中人教版第九单元 溶液课题2 溶解度第2课时练习
展开影响固体物质在溶剂中溶解度大小的因素有()
①固体溶质的性质②温度③压强④溶质的质量⑤溶剂的质量⑥溶剂的性质
A.①②⑥B.①③⑤
C.①④⑤D.②④⑥
下列关于溶液的说法中,不正确的是() A.溶液是一种混合物,各部分性质相同
不饱和溶液降温后可能变成饱和溶液
接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态
D.20 ℃,氯化钠的溶解度为 36 g,则 20 ℃时 100 g 氯化钠饱和溶液中含有氯化钠 36 g 3.下列关于溶解度的说法正确的是()
A.20 ℃时,20 g 某物质加入水里形成饱和溶液,所以该物质的溶解度为 20 g
B.20 ℃时,20 g 某物质溶解在 100 g 水里,所以该物质的溶解度为 20 g
C.20 g 某物质在 100 g 水里恰好饱和,所以该物质的溶解度为 20 g
D.20 ℃时,100 g 水里最多溶解某物质 20 g,所以该物质的溶解度为 20 g 4.甲、乙两种物质的溶解度曲线如图所示。下列叙述正确的是()
依据溶解度曲线可判断,甲的溶解度比乙的大
将甲、乙的饱和溶液从 t2 ℃降到 t1 ℃,析出甲的质量大
将 t2 ℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法
t1 ℃时,甲和乙的饱和溶液各 100 g,其溶质的质量一定相等
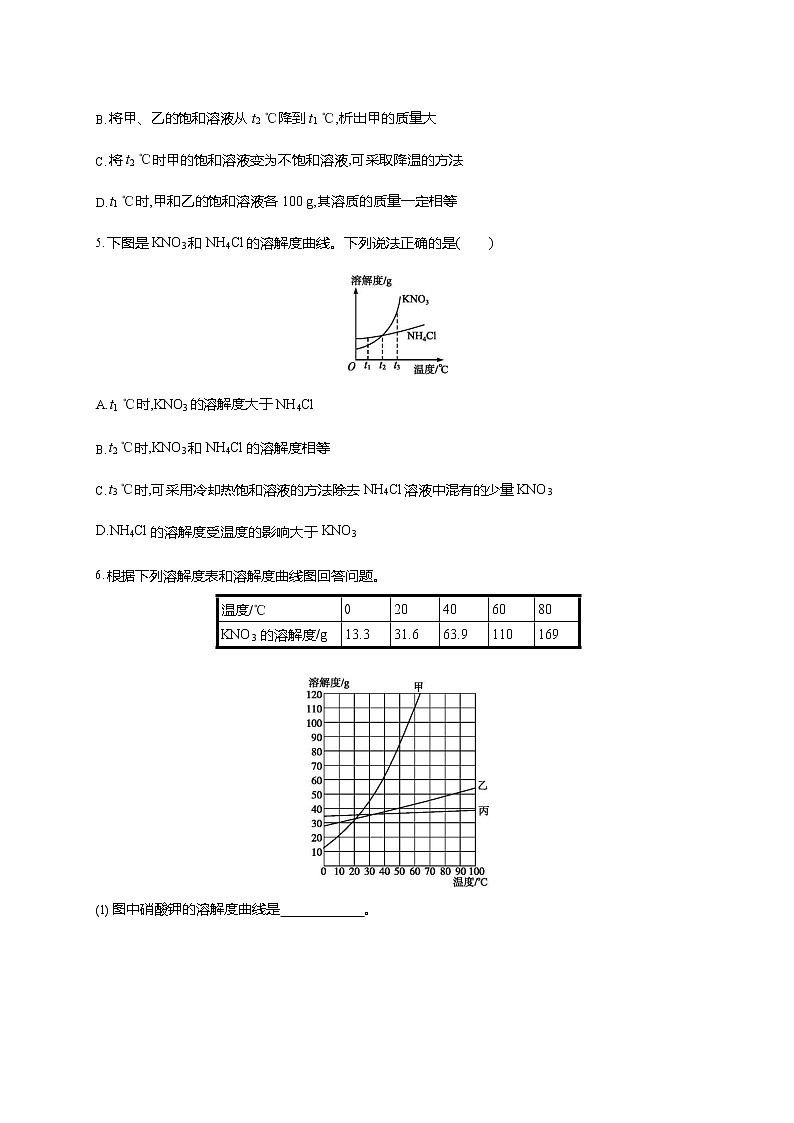
下图是KNO3 和 NH4Cl 的溶解度曲线。下列说法正确的是()
t1 ℃时,KNO3 的溶解度大于 NH4Cl
t2 ℃时,KNO3 和NH4Cl 的溶解度相等
t3 ℃时,可采用冷却热饱和溶液的方法除去 NH4Cl 溶液中混有的少量 KNO3 D.NH4Cl 的溶解度受温度的影响大于 KNO3
根据下列溶解度表和溶解度曲线图回答问题。
图中硝酸钾的溶解度曲线是 。
温度/℃
0
20
40
60
80
KNO3 的溶解度/g
13.3
31.6
63.9
110
169
50 ℃时,乙的溶解度为 。
60 ℃时,将甲、乙、丙的固体各 40 g 分别加入 100 g 水中充分溶解后,能形成饱和溶液的是 。
影响硝酸钾溶解度的因素是 。
A.温度B.压强C.水的量
下图是一瓶开启后的“××牌”碳酸饮料的示意图。
据图回答下列问题:
饮料成分中属于氧化物的是 (选填一种物质编号)。
开启时,大量的气泡从罐内冒出,该现象说明 的减小使气体的溶解度减小。(3)开启后可以闻到香味,请从分子的角度解释该现象: 。 8. 下表提供了 A、B 两种物质的溶解度数据,读取信息后回答:
A、B 物质都属于 (填“难溶”“微溶”“可溶”或“易溶”)物质。
A、B 两物质的溶解度随温度变化趋势的不同是 。如下图给出的曲线中, 与A 物质溶解度的变化趋势相符(填曲线编号)。
温度/℃
0
20
40
60
80
100
物质 A 的溶解度/g
27.6
34.0
40.0
45.5
51.1
56.7
物质 B 的溶解度/g
13.3
31.6
63.9
110
169
246
从A、B 两物质的混合物中分离出B 物质,一般采用 的方法。
下图为 A、B、C 三种固体物质的溶解度曲线图(A、B、C 析出晶体时均不含结晶水),根据曲线图回答下列问题。
t1 ℃时,溶解度最大的物质是 。
若将M 点处C 的不饱和溶液变成饱和溶液,可以选择的方法是 (填序号)。
A.降低温度B.增加溶质C.蒸发溶剂
t2 ℃时,将等质量的A、B、C 的饱和溶液都升温到 t3 ℃,溶液中溶剂质量的大小关系是(忽略水的挥发) 。
右图是 A、B、C 三种物质的溶解度曲线,请根据此图回答下列问题:
℃时,物质 A 和 C 的溶解度相等。
等质量的 A、B、C 三种物质的饱和溶液同时从 t2 ℃降温到 t1 ℃,仍为饱和溶液的是 。(3)t2 ℃时,A 物质的溶解度是 g。t2 ℃时,小丽向 100 g 的水中加入 50 g A 物质,意外发现全 部溶解,一段时间后又有部分A 物质的晶体析出,小丽认为“全部溶解”的原因是 。
★11.一些物质的溶解度曲线如下图所示,回答下列问题。
70 ℃时,在 100 g 水中加入 110 g 硝酸钾固体,所形成的溶液是 (填“饱和”或“不饱和”)溶液。
将上述溶液降温到 10 ℃时,析出的晶体质量是 g。
工业上将硝酸钾和氯化钠的热混合溶液(两者均已达到饱和)冷却至室温,析出晶体。
①析出晶体中的主要物质是 ;
②关于剩余溶液,下列说法正确的是 。
只含氯化钠,不含硝酸钾,且氯化钠达到饱和
既含有氯化钠,又含有硝酸钾,且只有氯化钠达到饱和 C.
既含有氯化钠,又含有硝酸钾,且两者都达到饱和
参考答案
1.A2.D3.D
4.D A 项未指明温度,不能比较两物质的溶解度大小,故错误;B 项未指明饱和溶液的质量,不能比较两溶液析出晶体质量的大小,故错误;C 项中,甲的溶解度随温度的升高而增大,将 t2 ℃时甲的饱和溶液变为不饱和溶液,不能采取降温的方法,故错误;D 项中,因 t1 ℃时甲和乙的溶解度相等,即此温度下,质量相等的甲和乙的饱和溶液中所含的溶质质量也必然相等,故D 正确。
5.B从图中看出,t1 ℃时,氯化铵的溶解度大于硝酸钾的溶解度,A 不正确;t2 ℃时,两物质的溶解度曲线相交,说明该温度下,两物质的溶解度相等,B 正确;t3 ℃时,硝酸钾的溶解度大于氯化铵的溶解度,冷却含少量氯化铵的硝酸钾饱和溶液,硝酸钾结晶析出,达到提纯硝酸钾的目的,但不能除去氯化铵饱和溶液中混有的少量硝酸钾,故C 不正确;硝酸钾的溶解度曲线比氯化铵的溶解度曲线斜率大,说明硝酸钾的溶解度受温度影响大,D 不正确。
6.答案 (1)甲(2)40 g(3)丙(4)A
解析 (1)从表格中的数据可以看出,硝酸钾的溶解度受温度变化影响较大,故甲可以表示其溶解度曲线。(2)从乙的溶解度曲线可以看出,50 ℃时,乙的溶解度是 40 g。(3)从溶解度曲线看出,60 ℃时,甲、乙的溶解度都大于 40 g,丙的溶解度小于 40 g,故将 40 g 三种固体分别加入 100 g 水中时,甲、乙均不
饱和,只有丙达到饱和,且有固体剩余。(4)固体的溶解度只与温度有关,与溶剂的量没有关系,与压强关系不大。
7.答案 (1)①或③ (2)压强
(3)分子在不断运动
解析 (1)在题图所示的四种物质中,水和二氧化碳都是氧化物。(2)开启后,罐内压强减小,大量气泡冒出,说明压强减小使气体的溶解度减小。(3)用分子运动论的观点解释。
答案 (1)易溶
B 物质的溶解度受温度影响比 A 物质大
③
降温结晶
答案 (1)C (2)BC (3)A=C
(3)45A 物质溶解时放出热量,使溶液的温度升高,A 的溶解度增大,50 g A 全部溶解;当温度降低后,溶解度又减小,又有 A 析出
解析 (1)物质 A 和C 的溶解度相等的点是两条溶解度曲线的交点,对应的温度为 t1 ℃。(2)饱和溶液降温时,A 和B 有晶体析出,仍为饱和溶液,而C 变成不饱和溶液。(3)t2 ℃时,A 物质的溶解度是
45 g,但 50 g 能够全都溶解,说明溶解度增大了,而溶解度一般来说只与温度有关,说明 A 物质溶解时放热,使得溶液温度升高,溶解度增大。一段时间后又有晶体析出,说明温度降低,溶解度又变小了。
11.答案 (1)不饱和(2)90
(3)①硝酸钾②C
解析 (1)根据溶解度曲线可知,70 ℃时硝酸钾的溶解度大于 110 g,故在 100 g 水中加入 110 g 硝酸钾时,所得溶液为不饱和溶液。(2)10 ℃时硝酸钾的溶解度为 20 g,析出晶体的质量为 110 g-20 g=90 g。(3)硝酸钾的溶解度随温度变化较大,而氯化钠的溶解度随温度变化不大,因而将两者的热饱和溶液降温时,析出的晶体主要是硝酸钾;因有晶体析出,剩余溶液仍为两者的饱和溶液。
人教版九年级下册课题2 溶解度第2课时巩固练习: 这是一份人教版九年级下册<a href="/hx/tb_c9866_t7/?tag_id=28" target="_blank">课题2 溶解度第2课时巩固练习</a>,共28页。PPT课件主要包含了学习目标,那该如何设计呢等内容,欢迎下载使用。
人教版九年级下册第九单元 溶液课题2 溶解度同步测试题: 这是一份人教版九年级下册第九单元 溶液课题2 溶解度同步测试题,共5页。
九年级下册课题2 溶解度随堂练习题: 这是一份九年级下册课题2 溶解度随堂练习题,共7页。试卷主要包含了饱和溶液与不饱和溶液,结晶,下列关于饱和溶液的说法正确的是等内容,欢迎下载使用。













