






新教材2022届新高考化学人教版一轮课件:8.2 水的电离和溶液的pH
展开[考试要求] 1.理解水的电离、离子积常数。 2.理解溶液pH的定义。学会测定溶液pH的方法并能进行pH的简单计算。 3.能根据中和滴定实验试题要求,分析或处理实验数据,得出合理结论。 4.能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
1知识梳理1.水的电离水是极弱的电解质,水的电离方程式为______________________或________________________。2.水的离子积常数Kw=c(H+)·c(OH-)。(1)室温下:Kw=__________。(2)影响因素:只与____有关,升高温度,Kw____。(3)适用范围:Kw不仅适用于纯水,也适用于稀的________水溶液。(4)Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw不变。
3.影响水电离平衡的因素(1)升高温度,水的电离程度________,Kw________。(2)加入酸或碱,水的电离程度________,Kw________。(3)加入可水解的盐(如FeCl3、Na2CO3),水的电离程度________,Kw________。
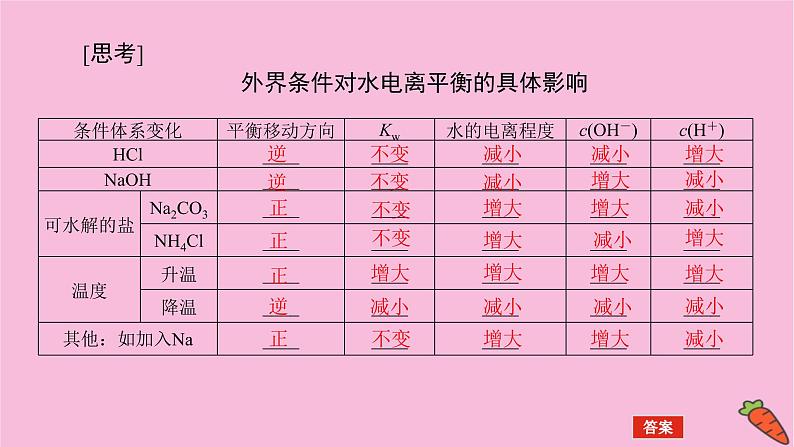
[思考]外界条件对水电离平衡的具体影响
[判断] (正确的打“√”,错误的打“×”)(1)纯水中c(H+)随着温度的升高而降低( )(2)25 ℃时,0.10 ml·L-1NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积变大( )(3)在蒸馏水中滴加浓H2SO4,Kw不变( )(4)向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变( )(5)向水中加入AlCl3溶液对水的电离不产生影响( )(6)100 ℃的纯水中c(H+)=1×10-6 ml·L-1,此时水呈酸性( )
[提醒](1)水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。(2)任何情况下水电离产生的c(H+)和c(OH-)总是相等的。升高温度,水的电离程度增大,c(H+)增大,pH减小,但仍呈中性。(3)水的离子积常数Kw=c(H+)·c(OH-),其实质是水溶液中的H+和OH-浓度的乘积,不一定是水电离出的H+和OH-浓度的乘积,所以与其说Kw是水的离子积常数,不如说是水溶液中的H+和OH-的离子积常数。即Kw不仅适用于水,还适用于酸性或碱性的稀溶液。
2对点速练练点一 水的电离平衡判断1.一定温度下,水存在H2O⇌H++OH- ΔH>0的平衡,下列叙述一定正确的是( )A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小B.将水加热,Kw增大,pH减小C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低D.向水中加入少量固体硫酸钠,c(H+)=10-7 ml·L-1,Kw不变
解析:A项,Kw应不变;C项,平衡应正向移动;D项,由于没有指明温度,c(H+)不一定等于10-7 ml·L-1。
2.下列有关水电离情况的说法正确的是( )A.100 ℃时,Kw=10-12,此温度下pH=7的溶液一定呈中性B.NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用C.25 ℃时,pH=12的烧碱溶液与纯碱溶液,水的电离程度相同D.如图为水的电离平衡曲线,若从A点到C点,可采用升高温度的方法
练后归纳正确理解水的电离平衡曲线(1)曲线上任意点的Kw都相同,即c(H+)·c(OH-)相同,温度相同。(2)曲线外在任意点与曲线上任意点的Kw不同,温度不同。(3)实现曲线上点之间的转化需保持温度不变,改变酸碱性;实现曲线上点与曲线外点之间的转化一定得改变温度。
练点二 水电离程度大小比较3.若往20 mL 0.01 ml·L-1 CH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是( )A.c点时,醋酸的电离程度和电离常数都最大,溶液呈中性B.若b点混合溶液显酸性,则2c(Na+)=c(CH3COO-)+c(CH3COOH)C.混合溶液中水的电离程度:b>c>dD.由图可知,该反应的中和热先增大后减小
解析:c点时,CH3COOH和NaOH恰好完全反应,得到CH3COONa溶液,由于CH3COO-水解,溶液呈碱性,A项错误;b点时,反应得到等物质的量浓度的CH3COOH、CH3COONa的混合溶液,根据物料守恒得2c(Na+)=c(CH3COOH)+c(CH3COO-),B项正确;b点为等物质的量浓度的CH3COOH、CH3COONa的混合溶液,c点为CH3COONa溶液,d点为等物质的量浓度的NaOH、CH3COONa的混合溶液,故c点水的电离程度最大,C项错误;中和热与酸碱的用量无关 ,中和热保持不变,D项错误。
4.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )A.两条曲线间任意点均有c(H+)·c(OH-)=KwB.M区域内任意点均有c(H+)<c(OH-)C.图中T1<T2D.XZ线上任意点均有pH=7
解析:由水的离子积的定义知两条曲线间任意点均有c(H+)·c(OH-)=Kw,A项正确;由图中纵横轴的大小可知M区域内任意点均有c(H+)<c(OH-),B项正确;温度越高,水的电离程度越大,电离出的c(H+)与c(OH-)越大,所以T2>T1,C项正确;XZ线上任意点都有c(H+)=c(OH-),只有当c(H+)=10-7ml·L-1时,才有pH=7,D项错误。
5.25 ℃时,将浓度均为0.1 ml·L-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )A.由图可知BOH一定是强碱B.Ka(HA)=1×10-6C.b点时,c(B-)=c(A-)=c(OH-)=c(H+)D.a→b过程中水的电离程度始终增大
水的电离是吸热过程,升高温度,平衡向正反应方向移动,c(H+)增大,c(OH-)增大,Kw=c(H+)·c(OH-),Kw增大
2.4×10-7 ml·L-1
考点二溶液的酸碱性与pH
1知识梳理1.溶液的酸碱性溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。(1)酸性溶液:c(H+)____c(OH-),常温下,pH____7。(2)中性溶液:c(H+)____c(OH-),常温下,pH____7。(3)碱性溶液:c(H+)____c(OH-),常温下,pH____7。
2.溶液的pH及其测量方法(1)计算公式:pH=________。(2)溶液的酸碱性与pH的关系常温下:(3)测量方法①pH试纸法:用镊子夹取一小块试纸放在洁净的______或______上,用玻璃棒蘸取待测液点在试纸的中央,变色后与标准比色卡对照,即可确定溶液的pH。pH试纸的适用范围0~14,使用时不能用蒸馏水湿润且只能测整数值。②pH计测量法。
[判断] (正确的打“√”,错误的打“×”)(1)任何温度下,利用H+和OH-浓度的相对大小均可判断溶液的酸碱性( )(2)某溶液的c(H+)>10-7 ml·L-1,则该溶液呈酸性( )(3)用蒸馏水润湿的pH试纸测溶液的pH,一定会使结果偏低( )(4)一定温度下,pH=a的氨水,稀释10倍后,其pH=b,则a=b+1( )(5)常温常压时,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合后,滴入石蕊溶液呈红色( )(6)根据溶液的pH判断该溶液的酸碱性( )(7)把pH=2与pH=12的酸、碱溶液等体积混合后,所得溶液的pH为7( )
[提醒](1)溶液呈现酸、碱性的实质是c(H+)与c(OH-)的相对大小,不能只看pH,一定温度下pH=6的溶液也可能显中性,也可能显酸性,应注意温度。(2)酸碱的强弱和溶液酸碱性的强弱不是等同关系:前者看电离程度,后者看溶液中c(H+)和c(OH-)的相对大小。强酸溶液的酸性不一定比弱酸溶液的酸性强。
2.在常温下,某溶液中由水电离出的c(H+)=1×10-11 ml·L-1,下列说法中正确的是( )A.该溶液肯定显碱性B.该溶液肯定显酸性C.该溶液的pH可能是11,也可能是3D.该溶液的pH肯定不是11
解析:首先要掌握本题中,由水电离出的c(H+)水=1×10-11 ml·L-1,则由水电离出的c(OH-)水=1×10-11 ml·L-1。如在酸溶液中,c(OH-)溶液=c(OH-)水=1×10-11 ml·L-1,此时c(H+)=1×10-3 ml·L-1,pH=3,溶液显酸性;又如在碱溶液中c(H+)溶液=c(H+)水=1×10-11 ml·L-1,此时溶液的pH=11,溶液显碱性。
3.常温下,有a ml·L-1HX和b ml·L-1HY两种酸溶液,下列说法不正确的是( )A.若a=b且c(X-)>c(Y-),则酸性:HX>HYB.若a>b且c(X-)=c(Y-),则酸性:HX>HYC.若a<b且两者pH相同,则HY一定是弱酸D.若向HX溶液中加入等浓度、等体积的NaOH溶液,所得溶液pH>7,则HX为弱酸
解析:若a=b且c(X-)>c(Y-),这说明电离程度HX>HY,则酸性:HX>HY,A正确;若a>b且c(X-)=c(Y-),这说明电离程度:HX<HY,则酸性:HX<HY,B错误;若a<b且两者pH 相同,这说明电离出的氢离子浓度相等,则HY一定是弱酸,C正确;若向HX溶液中加入等浓度、等体积的NaOH溶液,所得溶液pH>7,这说明X-水解,则HX为弱酸,D正确。
(3)室温下,已知酸和碱pH之和的溶液等体积混合酸碱性分析(两强混合)a.若pH之和等于14,则混合后溶液显中性,pH=7。b.若pH之和大于14,则混合后溶液显碱性,pH>7。c.若pH之和小于14,则混合后溶液显酸性,pH<7。
练点二 溶液pH的计算4.常温下,下列叙述正确的是( )A.将pH=a的氨水稀释10倍后,其pH=b,则a=b+1B.将pH=3.0的盐酸稀释105倍后,溶液的pH=8.0C.将pH=9.0的NaOH溶液与pH=11.0的NaOH溶液等体积混合,所得溶液的pH=9.3D.若将1 mL pH=1.0的盐酸与100 mL NaOH溶液混合后,溶液的pH=7.0,则NaOH溶液的pH=11.0
5.下列说法不正确的是( )A.室温下,0.01 ml·L-1的盐酸中由水电离出的c(H+)为1.0×10-12 ml·L-1B.室温下,0.01 ml·L-1的NaOH溶液中由水电离出的c(OH-)为1.0×10-12 ml·L-1C.室温下,在pH=11的某溶液中,由水电离出的c(OH-)为1.0×10-3 ml·L-1D.室温下,若某溶液中由水电离出的c(H+)=1.0×10-13 ml·L-1,则该溶液的pH可能是1或13
解析:盐酸中OH-只来源于水的电离,由题知c(H+)=0.01 ml·L-1,根据水的离子积常数Kw得,c水(OH-)=c水(H+)=1.0×10-12 ml·L-1,A项正确;与A项类似,c水(H+)=c水(OH-)=1.0×10-12 ml·L-1,B项正确;应考虑该溶液是碱溶液还是水解呈碱性的盐溶液两种情况,若是碱溶液,H+由H2O电离产生,c水(H+)=c水(OH-)=1.0×10-11 ml·L-1,若是盐溶液(如Na2CO3溶液),OH-由H2O电离产生,即c水(OH-)=1.0×10-3 ml·L-1,C项错误;室温下,该溶液中c水(H+)<1.0×10-7 ml·L-1,即水的电离被抑制,故该溶液可能为酸溶液,也可能为碱溶液,若为酸溶液,则溶液中c(OH-)=c水(H+)=1.0×10-13 ml·L-1,根据水的离子积常数Kw得,溶液中c(H+)=0.1 ml·L-1,pH=1;若为碱溶液,则溶液中c(H+)=1.0×10-13 ml·L-1,pH=13,D项正确。
6.25 ℃时,将体积为Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合。(1)若所得溶液的pH=11,且a=13,b=2,则Va∶Vb=________。(2)若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值是否可以等于4?________(填“是”或“否”)。
方法总结溶液pH计算的一般思维模型
练点三 与稀释有关的图像分析7.pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 ml/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )A.x为弱酸,Vx
解析:由图知:将一元酸x和y分别稀释10倍,pH的变化量ΔpHx=1,ΔpHy<1,所以x为强酸,y为弱酸。pH=2时弱酸y的浓度大,滴加NaOH溶液至需NaOH溶液的体积y要比x大。
3.仪器与试剂(1)主要仪器:__________、__________、铁架台(带滴定管夹)、______、大烧杯。(2)试剂标准液、待测液、指示剂、蒸馏水。
4.中和滴定实验操作(1)滴定前的准备。
(2)滴定。(3)终点判断:等到滴入最后一滴反应液,指示剂变色,且在________内不能恢复原来的颜色,视为滴定终点,并记录标准液的体积。(4)数据处理:按上述操作重复2~3次,求出用去标准盐酸体积的平均值,根据原理计算。
锥形瓶内溶液的颜色变化
5.常用酸碱指示剂及变色范围
[思考]下列滴定中,写出指示剂和滴定终点颜色变化已知:2KMnO4+5K2SO3+3H2SO4===6K2SO4+2MnSO4+3H2O、I2+Na2S===2NaI+S↓
[判断] (正确的打“√”,错误的打“×”)(1)滴定终点就是酸碱恰好中和的点( )(2)滴定管盛标准液时,其液面一定要调在0刻度( )(3)用碱式滴定管量取20.00 mL KMnO4溶液( )(4)滴定管在加入反应液之前一定要用所要盛装的反应液润洗2~3遍( )(5)若用标准盐酸滴定待测NaOH溶液,滴定前仰视,滴定后俯视则测定值偏大( )(6)中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2~3 mL( )(7)中和滴定实验中,必须用待装标准液润洗滴定管,用待测液润洗锥形瓶( )(8)中和滴定时,眼睛必须注视滴定管中的液面变化( )
[提醒]选择指示剂的三个标准(1)变色范围与终点pH吻合或接近;(2)指示剂变色范围越窄越好;(3)指示剂在滴定终点时颜色变化要明显,容易观察判断。
2对点速练练点一 中和滴定基本操作1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度(如图所示),下表中正确的选项是( )
解析:解答本题的关键是:①明确酸、碱式滴定管使用时的注意事项,②指示剂的变色范围。酸式滴定管不能盛放碱,而碱式滴定管不能盛放酸,指示剂应选择颜色变化明显的酚酞或甲基橙,不能选用石蕊。
2.关于下列各实验或装置的叙述中,不正确的是( )
A.实验①可用于测溶液pHB.实验②是用酸性KMnO4溶液滴定C.装置③是滴定操作时手的操作D.装置④中最后一滴NaOH标准液使溶液由无色变为红色,即达到滴定终点
解析:A、B、C三项均正确;装置④中最后一滴NaOH标准液使溶液由无色变为红色,半分钟不恢复成原来的颜色,即达到滴定终点,D项错误。
3.某学生用0.150 0 ml·L-1NaOH溶液测定某未知浓度的盐酸,其操作可分解为如下几步:( )A.用蒸馏水洗净滴定管B.用待测定的溶液润洗酸式滴定管C.用酸式滴定管取稀盐酸25.00mL,注入锥形瓶中,加入酚酞D.另取锥形瓶,再重复操作2~3次E.检查滴定管是否漏水F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面到“0”刻度或“0”刻度以下G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:(1)滴定时正确操作的顺序是(用字母填写): → →F→ → → →D(2)操作F中应该选择如图中滴定管 (填“甲”或“乙”)。
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察 。滴定终点溶液颜色的变化是_______________________________________________________。
锥形瓶内溶液颜色的变化
锥形瓶内溶液由无色变为浅红色,且半分钟内不褪色
(4)滴定结果如表所示:计算该盐酸的物质的量浓度为 (精确至0.000 1)。
0.120 0 ml·L-1
练点二 数据处理与误差分析4.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )A.用量筒量取NaOH溶液时仰视读数B.滴定结束后,滴定管尖嘴处有一悬挂液滴C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
解析:取NaOH溶液仰视读数,会使NaOH溶液的体积偏大,造成消耗盐酸的体积偏大,测定结果偏高,A错误;滴定结束后,滴定管尖嘴处有一悬挂液滴,会使消耗的盐酸的体积偏大,测定结果偏高,B错误;锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度,会造成滴定终点的误判,使消耗盐酸的体积偏小,测定结果偏低,C正确;盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次,会使NaOH溶液的体积偏大,造成消耗盐酸的体积偏大,测定结果偏高,D错误。
5.欲测定某NaOH溶液的物质的量浓度,可用0.100 0 ml·L-1的盐酸标准溶液进行中和滴定(用甲基橙作指示剂)。请回答下列问题:(1)滴定时,盛装待测NaOH溶液的仪器名称为 。(2)盛装标准盐酸的仪器名称为 。(3)滴定至终点的颜色变化为 。(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50 mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(5)乙学生做了三组平行实验,数据记录如下:选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 。(保留四位有效数字)(6)下列哪些操作会使测定结果偏高 (填字母)。A.锥形瓶用蒸馏水洗净后再用待测液润洗B.酸式滴定管用蒸馏水洗净后再用标准液润洗C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失D.滴定前读数正确,滴定后俯视滴定管读数
0.105 2 ml·L-1
(6)A项,锥形瓶用待测液润洗,会使锥形瓶内溶质的物质的量增大,造成V(标准)偏大,c(待测)偏高,正确;B项,酸式滴定管用蒸馏水洗净后再用标准液润洗,对V(标准)无影响,c(待测)不变,错误;C项,滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,造成V(标准)偏大,c(待测)偏高,正确;D项,滴定前读数正确 ,滴定后俯视滴定管读数,造成V(标准)偏小,c(待测)偏低,错误。
练后归纳1.滴定管读数要领以凹液面的最低点为基准(如图)正确读数(虚线部分)和错误读数(实线部分)。
(2)误差分析结论以标准酸溶液滴定未知浓度的碱(酚酞作指示剂)为例,常见的因操作不正确而引起的误差有:
练点三 滴定曲线分析6.常温下,用0.10 ml·L-1NaOH溶液分别滴定20.00 mL 0.10 ml·L-1HCl溶液和20.00 mL 0.10 ml·L-1CH3COOH溶液,得到两条滴定曲线,如图所示,则下列说法正确的是( )A.图2是滴定盐酸的曲线B.a与b的关系是a<bC.E点对应离子浓度由大到小的顺序可能为 c(CH3COO-)>c(Na+)>c(H+)>c(OH-)D.这两次滴定都可以用甲基橙作为指示剂
解析:如果酸为强酸,则0.10 ml·L-1酸的pH为1,根据酸的初始pH知,图1为盐酸的滴定曲线,故A错误;根据图1知,a点氢氧化钠溶液的体积是20.00 mL,酸和碱的物质的量相等,二者恰好反应生成强酸强碱盐,其溶液呈中性;醋酸溶液中滴入氢氧化钠溶液,醋酸钠溶液呈碱性,所以氢氧化钠溶液的体积小于20.00 mL,a>b,故B错误;E点溶液的成分为醋酸钠和醋酸,溶液呈酸性,说明醋酸的电离程度大于醋酸钠的水解程度,盐类水解程度较小,则溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;氢氧化钠和盐酸恰好反应呈中性,可以选择甲基橙或酚酞;氢氧化钠和醋酸恰好反应生成醋酸钠溶液呈碱性,只能选择酚酞,故D错误。
7.取未知浓度的硫酸、盐酸和醋酸各25.00 mL,分别用0.10 ml·L-1的NaOH溶液或0.10 ml·L-1的稀氨水滴定得到如图曲线。下列说法正确的是( )A.由图可知曲线c为NaOH滴定硫酸B.由图可知硫酸的物质的量浓度大于盐酸的物质的量浓度C.曲线b、c的滴定实验可用酚酞作指示剂D.由图可知滴定前醋酸的物质的量浓度为0.06 ml·L-1
解析:A项,由图像可知加入NaOH溶液或氨水时,a的pH在开始阶段变化较大,应为碱滴定弱酸的变化曲线,则b、c为硫酸和盐酸的滴定曲线,由于浓度未知,则不能确定b、c,错误;B项,硫酸、盐酸都为强酸,题图中纵坐标为pH,不能确定浓度的大小,错误;C项,如用氨水和,滴定终点时溶液呈现酸性,应用甲基橙为指示剂,错误;D项,开始时醋酸的pH为3,H+浓度为0.001 ml·L-1,滴定终点时消耗NaOH的体积为15 mL,则有c×0.025 L=0.10 ml·L-1×0.015 L,解c=0.06 ml·L-1,正确。
8.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 ml·L-1的等体积的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示:请按要求回答下列问题:(1)三种酸的电离常数分别为KHA、KHB、KHD,其中最大的是 。(2)当滴定至P点时,该溶液中各种离子浓度由大到小依次是 。(3)若分别滴定到pH=7,此时三种溶液中的主要阴离子浓度大小关系为 。(4)当中和百分数达100%时,所需n(NaOH)的大小关系是 ;若将此时的三种溶液混合,其中的c(OH-)= (用溶液中其他粒子的浓度表示)。
c(B-)>c(Na+)>c(H+)>c(OH-)
c(A-)>c(B-)>c(D-)
c(HA)+c(HB)+c(HD)+c(H+)
解析:(1)根据图像可知,在未滴加NaOH溶液时,0.1 ml·L-1的三种酸(HA、HB和HD)溶液的pH均大于1,说明三种酸均为弱酸,且HA的pH最小、酸性最强,HD的pH最大、酸性最弱,因酸性越强,电离常数越大,故KHA>KHB>KHD。(2)滴定至P点时,溶液中未反应的HB与生成的NaB的浓度相等,且溶液呈酸性,说明HB的电离程度大于B-的水解程度,故c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)。(3)pH=7时,根据电荷守恒,三种离子的浓度分别等于c(Na+),然而三种溶液中阴离子水解程度不同,pH=7时加入的NaOH的体积不同,即酸性越强,加入氢氧化钠越多,钠离子浓度越大,所以c(A-)>c(B-)>c(D-)。(4)中和百分数100%指的是三种酸恰好完全反应,根据酸的物质的量相同,所以需要氢氧化钠的量完全相同;根据质子守恒即可得出,完全中和后的三种溶液混合后溶液的质子守恒关系:c(HA)+c(HB)+c(HD)+c(H+)=c(OH-)。
方法技巧中和滴定曲线分析技巧 首先看纵坐标,搞清楚是酸加入碱中,还是碱加入酸中,然后看起点,起点可以看出酸性或碱性的强弱,这在判断滴定终点时至关重要;再次找滴定终点和pH=7的中性点,判断滴定终点的酸碱性,然后确定中性点(pH=7)的位置;最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。
本讲真题研练1.[2020·全国卷Ⅰ,13]以酚酞为指示剂,用0.100 0 ml·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如下图所示。下列叙述正确的是( )A.曲线①代表δ(H2A),曲线②代表δ(HA-)B.H2A溶液的浓度为0.200 0 ml·L-1C.HA-的电离常数Ka=1.0×10-2D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
2.[2020·浙江1月,23]室温下,向20.00 mL 0.100 0 ml·L-1盐酸中滴加0.100 0 ml·L-1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg 5=0.7。下列说法不正确的是( )A.NaOH与盐酸恰好完全反应时, pH=7B.选择变色范围在pH突变范围内的指示剂,可减小实验误差C.选择甲基红指示反应终点,误差比甲基橙的大D.V(NaOH)=30 mL时,pH=12.3
解析:本题考查酸碱中和滴定过程中溶液pH随NaOH溶液体积变化的关系。由题图可知,甲基橙变色范围在突变范围之外,甲基红变色范围在突变范围内,接近反应终点,甲基橙误差会更大,C错误;因为是一元强酸与一元强碱之间的反应,恰好完全反应时pH=7,A正确;指示剂的变色范围应该在中和滴定pH突变范围内,这样的误差较小,B正确;当消耗NaOH溶液体积为30 mL时,反应后溶液中c(OH-)=0.02 ml·L-1,pH约为12.3,D正确。
3.[2020·江苏卷,18]次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的离子方程式为 ;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是______________________________________________。
Cl2+2OH-===ClO-+Cl-+H2O
NaClO溶液吸收空气中的CO2后产生HClO,HClO见光分解
4.[2019·全国卷Ⅰ,11]NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3 ,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )A.混合溶液的导电能力与离子浓度和种类有关B.Na+与A2-的导电能力之和大于HA-的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
解析:KHA与NaOH反应的过程中引入了Na+,HA-转化为A2-,由图像可知a到b过程中导电能力逐渐增强,A、B项正确;b点时,KHA与NaOH恰好完全反应生成正盐,A2-水解使溶液呈碱性,C项错误;b点时,Na+、K+浓度相等,继续滴加NaOH溶液至c点,c(Na+)增大,由图可知c(OH-)小于c(K+),D项正确。
5.[2019·北京卷,26]化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。Ⅰ.用已准确称量的KBrO3固体配制一定体积的a ml·L-1 KBrO3标准溶液;Ⅱ.取V1 mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;Ⅲ.向Ⅱ所得溶液中加入V2 mL废水;Ⅳ.向Ⅲ中加入过量KI;Ⅴ.用b ml·L-1Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液V3 mL。已知:I2+2Na2S2O3===2NaI+Na2S4O6Na2S2O3和Na2S4O6溶液颜色均为无色
(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。(2)Ⅱ中发生反应的离子方程式是____________________________________________________。(3)Ⅲ中发生反应的化学方程式是________________________________________________________。(4)Ⅳ中加KI前,溶液颜色须为黄色,原因是________________________________________________________。
Br2过量,保证苯酚完全反应
(5)KI与KBrO3物质的量关系为n(KI)≥6n(KBrO3)时,KI一定过量,理由是________________________________________。(6)Ⅴ中滴定至终点的现象是_____________________。(7)废水中苯酚的含量为 g·L-1(苯酚摩尔质量:94 g·ml-1)(8)由于Br2具有 性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。
反应物用量存在关系:KBrO3~3Br2~6KI,若无苯酚时,消耗KI物质的量是KBrO3物质的量的6倍,因有苯酚消耗Br2,所以当n(KI)≥6n(KBrO3)时,KI一定过量
解析:(1)配制标准溶液用到的玻璃仪器除了给出的三种仪器外,还有容量瓶。(4)溶液为黄色说明仍有Br2存在,此时废水中的苯酚已完全反应。(5)假设废水中没有苯酚,KBrO3和KBr反应生成的Br2完全和KI反应时,消耗KI的物质的量刚好是KBrO3的6倍。实际上苯酚一定会消耗一定量的Br2,所以当n(KI):n(KBrO3)=6:1时,KI就已经过量了。
(8)当Br2挥发掉后,在Ⅴ步骤中消耗的Na2S2O3的量减少,即V3减小,导致测定结果偏高。
2023届高三化学高考备考一轮复习 水的电离和溶液的pH课件: 这是一份2023届高三化学高考备考一轮复习 水的电离和溶液的pH课件,共40页。PPT课件主要包含了水的电离,归纳总结,溶液的酸碱性和pH等内容,欢迎下载使用。
人教版高考化学一轮复习8.2水的电离和溶液的ph课件: 这是一份人教版高考化学一轮复习8.2水的电离和溶液的ph课件
人教版高考化学一轮总复习课时质量评价29水的电离和溶液的pH课件: 这是一份人教版高考化学一轮总复习课时质量评价29水的电离和溶液的pH课件,共39页。












