



新教材2022届新高考化学人教版一轮课件:微专题·大素养 15 溶液中离子浓度大小判断
展开
这是一份新教材2022届新高考化学人教版一轮课件:微专题·大素养 15 溶液中离子浓度大小判断,共29页。PPT课件主要包含了三个基本平衡常数等内容,欢迎下载使用。
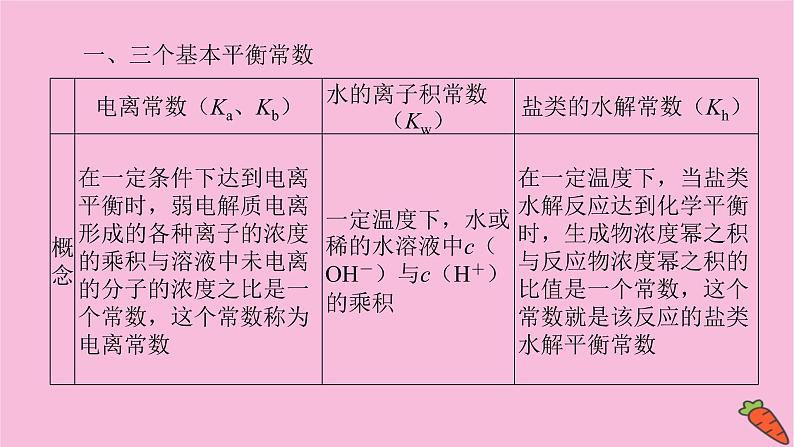
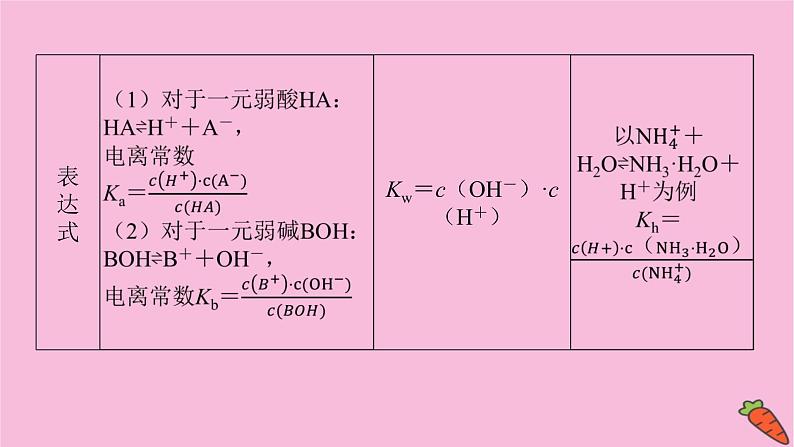
溶液中离子浓度大小判断【知识基础】判断溶液中离子浓度大小关系,必须掌握溶液中的各种电离过程、反应过程、平衡过程,透彻理解三个基本平衡常数,准确把握三个守恒关系。
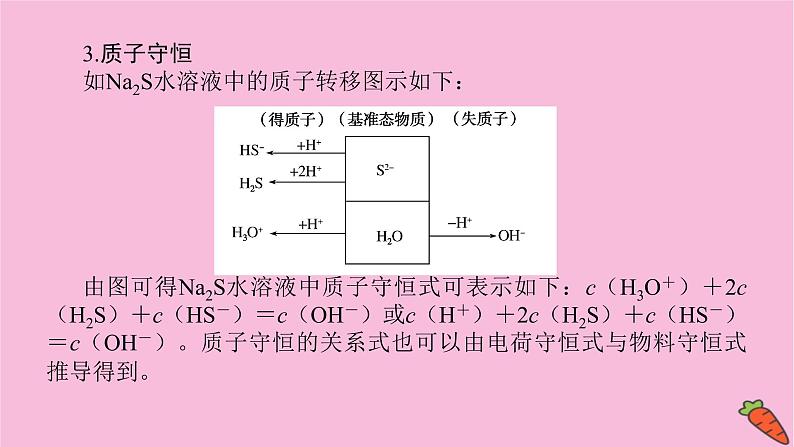
3.质子守恒如Na2S水溶液中的质子转移图示如下:由图可得Na2S水溶液中质子守恒式可表示如下:c(H3O+)+2c(H2S)+c(HS-)=c(OH-)或c(H+)+2c(H2S)+c(HS-)=c(OH-)。质子守恒的关系式也可以由电荷守恒式与物料守恒式推导得到。
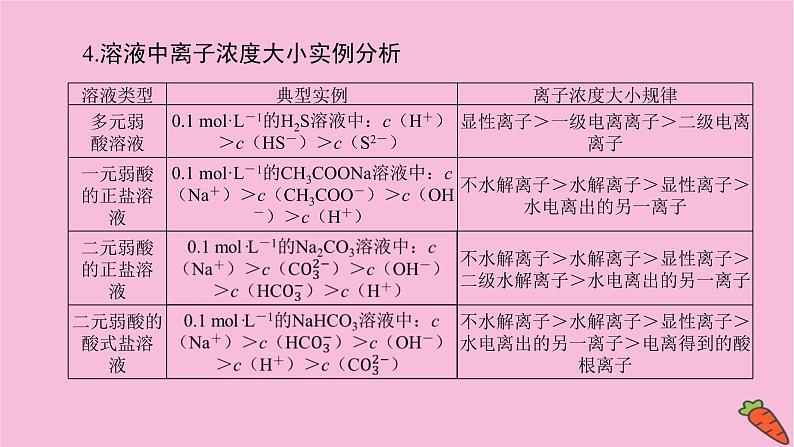
4.溶液中离子浓度大小实例分析
2.有4种混合溶液,分别由下列等体积的0.1 ml·L-1的两种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3。下列各项排序中正确的是( )A.pH:②>③>④>①B.c(CH3COOH):①>④>③>②C.c(CH3COO-):②>④>③>①D.溶液中c(H+):①>③>②>④
4.室温下,取20 mL 0.1 ml·L-1某二元酸H2A,滴加0.2 ml·L-1NaOH溶液。已知:H2A===H++HA-,HA-⇌H++A2-。下列说法不正确的是( )A.0.1 ml·L-1H2A溶液中有c(H+)-c(OH-)-c(A2-)=0.1 ml·L-1B.当滴加至中性时,溶液中c(Na+)=c(HA-)+2c(A2-),用去NaOH溶液的体积小于10mLC.当用去NaOH溶液体积10 mL时,溶液的pHc(OH-)>c(H+)
解析:A.根据图像中酸分子的分布分数大小进行判断,酸分子的分布分数越大,酸性越弱;B.根据图像中给定的信息pH=4.88时,c(CH3CH2COOH)=c(CH3CH2COO-),并结合电离方程式进行解析;C.弱酸溶液加水稀释,促进弱酸的电离;D.根据图示信息,甲酸的电离平衡常数10-3. 75,电离程度大于HCOO-水解程度,所以HCOOH与HCOONa(1:1)的混合液显酸性。据此解答问题。由图中信息可知,相同pH时,丙酸的酸分子的分布分数大,说明电离程度小,故其酸性比甲酸弱,A错误;pH=4.88时,丙酸的酸分子的分布分数为50%,即c(CH3CH2COOH)=c(CH3CH2COO-), 针对CH3CH2COOH⇌CH3CH2COO-+H+电离过程可知,lg K=lg c(H+)=-4.88,B正确;稀释弱酸,电离程度增大,故0.1 ml·L-1甲酸溶液的pH=2.33,则0.01 ml·L-1甲酸溶液的pH
相关课件
这是一份2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡微专题大素养22溶液中“四大常数”的相关计算课件,共17页。PPT课件主要包含了答案B,答案C,3≤pH<9等内容,欢迎下载使用。
这是一份2023高考化学总复习微专题大素养溶液中离子浓度大小判断15课件,共26页。PPT课件主要包含了答案D,答案C,答案B等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习微专题大素养15溶液中离子浓度大小判断课件









