





初中化学北京课改版九年级下册第三节 溶解度教学演示ppt课件
展开内因:溶质和溶剂的性质
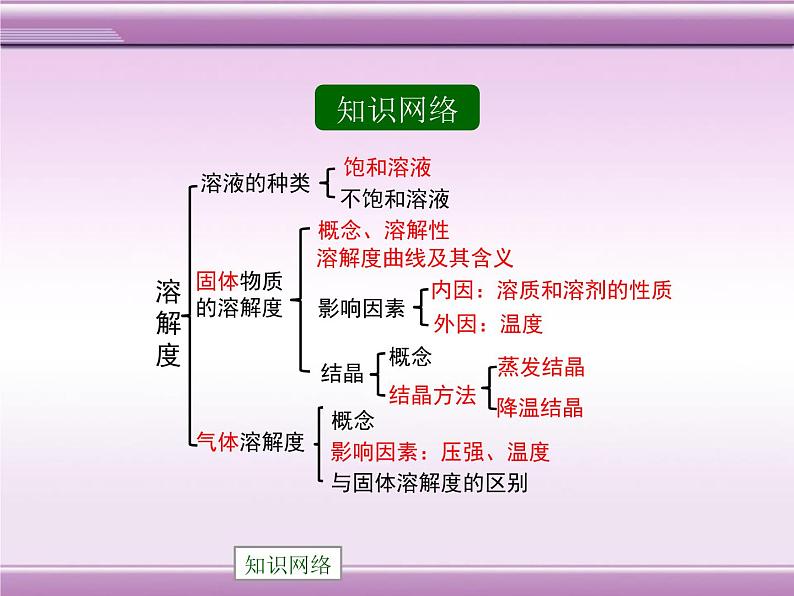
知识点1 饱和溶液与不饱和溶液
1.概念:在一定的温度下,在一定量的溶剂里,___________________________的溶液,叫做这种溶质的饱和溶液;________________________的溶液,叫做这种溶质的不饱和溶液。
不能再继续溶解某种溶质
PPT模板: PPT素材:背景: PPT图表: PPT下载: PPT教程: 资料下载: 范文下载: 试卷下载: 教案下载: PPT论坛: PPT课件: 语文课件: 数学课件: 英语课件: 美术课件: 科学课件: 物理课件: 化学课件: 生物课件: 地理课件: 历史课件:
2.判断方法(1)当溶液中有固态溶质时,若固体________,那么该溶液是饱和的,若固体_____,那么该溶液是不饱和的;(2)当溶液中没有固态溶质时,向溶液中加入少量相应的溶质,若溶质_________,则原溶液是饱和的,若溶质_________,则原溶液是不饱和的。(3)当溶液中有晶体析出时,析出晶体后的溶液一定是饱和溶液。
[注意] ①某饱和溶液是对相应的溶质不能继续溶解的溶液,但还可以溶解其他的物质。如某饱和食盐水中还可以继续溶解硝酸钾固体。
②对多数固体溶质而言,通过降低温度可实现由不饱和溶液向饱和溶液的转化,但对溶解度随温度升高而减小的物质(如气体、熟石灰等),则需升高温度将其不饱和溶液转化为饱和溶液。③对某饱和溶液进行降温或蒸发溶剂,往往会有溶质从溶液中以晶体形式析出。
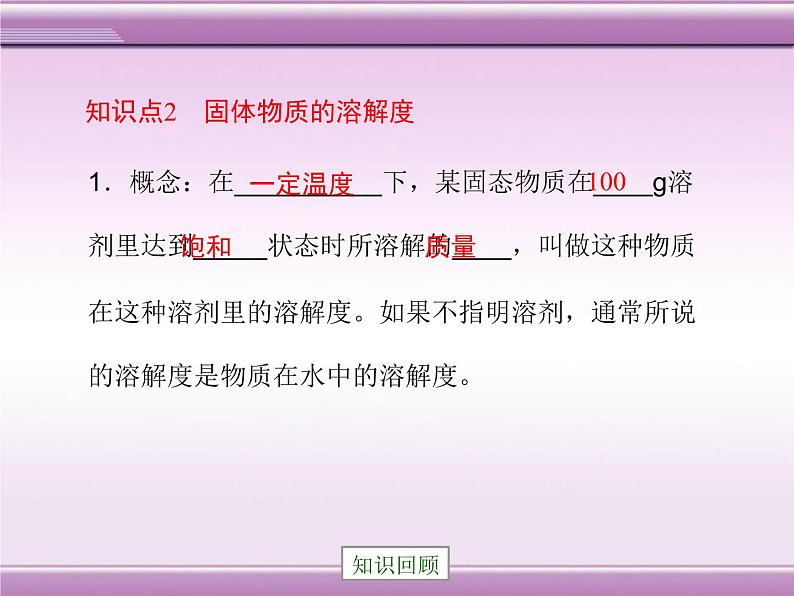
1.概念:在__________下,某固态物质在____g溶剂里达到_____状态时所溶解的____,叫做这种物质在这种溶剂里的溶解度。如果不指明溶剂,通常所说的溶解度是物质在水中的溶解度。
知识点2 固体物质的溶解度
2.影响因素:①内因:溶质和溶剂的性质;②外因:主要是_____。多数物质的溶解度随温度的升高而增大,如______;少数物质的溶解度受温度的影响很小,如_____;极少数物质的溶解度随温度的升高而减小,如________。
1.概念:是指在一定温度下,压强为_________时,某气体溶解在___体积的水中达到____状态时的气体_____。2.影响因素:①内因:气体的性质;②外因:主要是温度和压强。温度越高,气体的溶解度____,压强越大,气体的溶解度____。
知识点3 气体的溶解度
1.概念:指溶解度随温度变化的曲线。横坐标表示_____,纵坐标表示_______。2.含义:①曲线上的点,表示某物质的饱和溶液;②曲线的走向表示某物质的溶解度随温度的变化情况;③两条溶解度曲线的交点表示两种溶质在某一温度下的溶解度相同3.应用:①查找某一温度下物质的溶解度;②比较某一温度下两种物质溶解度的大小;③选择使某种物质从溶液中结晶的方法。
►类型一 饱和溶液与不饱和溶液的判断方法与转化方法例1下列有关饱和溶液的说法中,正确的是( )A.饱和溶液的溶质质量分数一定比不饱和溶液的大B.饱和溶液降温析出晶体后的溶液一定是不饱和溶液C.任何饱和溶液升温后都会变成不饱和溶液D.一定温度下,向氯化钠饱和溶液中加入水后会变成不饱和溶液
命题角度:考查学生对溶液是否饱和的判断方法及饱和溶液与不饱和溶液相互转化方法的掌握情况。[解析] 饱和溶液的溶质质量分数不一定比不饱和溶液大,只有在同一温度下,对同一种溶质而言,此说法才成立;饱和溶液降温析出晶体后的溶液仍是饱和溶液;对于溶解度随温度升高而降低的物质来说,将其饱和溶液升高温度后会有晶体析出,溶液仍为饱和溶液。
变式题 将一瓶接近饱和的硝酸钾溶液变成饱和溶液,可采用的方法是_______________________________________________________(任写一种)。[方法点拨] 判断饱和溶液与不饱和溶液时,分两种情况:一是当溶液中没有固体溶质存在时,向溶液中加入相应的溶质,如果不溶解,则溶液饱和,反之,溶液不饱和;二是当溶液中有固体溶质存在时,看固体溶质是否减少,若不减少,溶液饱和,否则溶液为不饱和。
加入硝酸钾(溶质)[或降低温度,或蒸发水(溶剂),任答一条即可]
在进行饱和溶液与不饱和溶液相互转化时,一般可以通过改变溶剂的量、溶质的量和温度实现。但对于不同的物质,其改变的方法是不同的,如对于溶解度随温度升高而减小的物质,要将其饱和溶液变成不饱和溶液,需要采取降温的方法。[解析] 接近饱和的硝酸钾溶液即为硝酸钾的不饱和溶液,向其中加少量的硝酸钾晶体或降温或蒸发溶剂均可使其变成饱和溶液。
►类型二 溶解度的含义命题角度:通过对具体数据的分析,考查学生对溶解度含义的理解。例2 下列关于氯化钠溶解度的说法正确的是 ( )A.t ℃时10 g氯化钠能溶解在100 g水中,所以t ℃时氯化钠的溶解度是10 gB.t ℃时10 g氯化钠溶解在水中能形成100 g饱和溶液,所以t ℃时氯化钠的溶解度是10 gC.把20 g氯化钠溶解在100 g水中恰好达到饱和,所以氯化钠的溶解度是20 gD.t ℃时把36 g氯化钠溶解在100 g水中恰好饱和,所以t ℃时氯化钠的溶解度是36 g
[方法点拨] 判断溶解度的关键是看所给数据是否具备以下几个要素:一定的温度,溶剂的质量是100 g,溶液处于饱和状态。缺少其中任何一点,都不能认定为溶解度,而只能认定是溶解的量。
► 类型三 溶解度曲线的含义及其应用命题角度:根据所给的溶解度曲线,分析其所包含的信息并能够加以应用。例3 图8-1表示M、N两种固体物质的溶解度曲线,下列对图示信息的描述正确的是( )
A.30 ℃时M的溶解度小于N的溶解度B.P点表示t ℃时M、N的溶解度相等C.M、N都是难溶物质D.阴影处各点对应的溶液(不包含曲线上的点)是M的不饱和溶液,N的饱和溶液
[解析] 由溶解度曲线可以看出,30 ℃时,M的溶解度大于N的溶解度;P点是两条曲线的交点,表示两种物质在相应温度下的溶解度相等;在20 ℃时,两种物质的溶解度均大于10 g,均属于易溶物质;阴影部分的点在N的下方而在M的上方,对物质N来说表示不饱和溶液,对M来说表示饱和溶液。
变式题将a、b两种物质的饱和溶液升高温度后,发现a溶液有晶体析出,b溶液没有明显现象。再向b溶液加入少许b晶体,晶体消失。则图8-2中能正确表示a、b两物质溶解度曲线的是( )
初中化学人教版九年级下册课题2 溶解度教课内容ppt课件: 这是一份初中化学人教版九年级下册课题2 溶解度教课内容ppt课件,共29页。PPT课件主要包含了条件一定温度,溶解度的表示方法,答案C,课堂小结,溶解度,影响因素,固体溶解度,TT↗S↘,PP↗S↗,溶解度曲线等内容,欢迎下载使用。
09.微专题9 溶解度及溶解度曲线课件PPT: 这是一份09.微专题9 溶解度及溶解度曲线课件PPT,共34页。PPT课件主要包含了甲=乙丙,蒸发结晶,升温结晶,不饱和,增加溶剂,降低温度,丙甲=乙,KNO3,~40℃,~30℃等内容,欢迎下载使用。
人教版九年级下册课题2 溶解度图文ppt课件: 这是一份人教版九年级下册课题2 溶解度图文ppt课件,共60页。PPT课件主要包含了实验9-6,讨论3,溶解度,第三课时,河头中学骆勤华等内容,欢迎下载使用。














