








所属成套资源:化学人教版九年级下整册多媒体课件PPT+教案+练习
人教版九年级下册实验活动6 酸、碱的化学性质试讲课习题ppt课件
展开
这是一份人教版九年级下册实验活动6 酸、碱的化学性质试讲课习题ppt课件,文件包含化学人教版九年级下册第十单元《实验活动6酸碱的化学性质》课件pptx、化学人教版九年级下册第十单元《实验活动6酸碱的化学性质》同步练习docx、化学人教版九年级下册第十单元《实验活动6酸碱的化学性质》教案docx等3份课件配套教学资源,其中PPT共19页, 欢迎下载使用。
1.加深对酸和碱的主要性质的认识。 2.通过实验解释生活中的一些现象。
【实验用品】 试管、药匙、蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈)、坩埚钳、胶头滴管、火柴。稀盐酸、稀硫酸、稀氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。
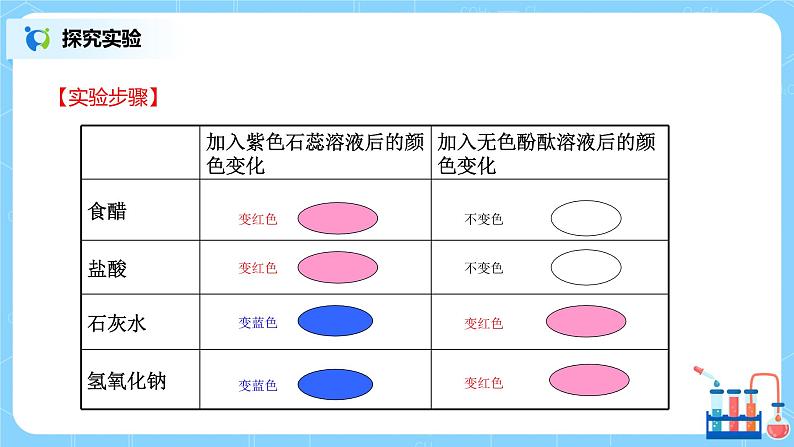
【实验步骤】 1.参考下图进行实验,比较酸和碱与指示剂的作用。
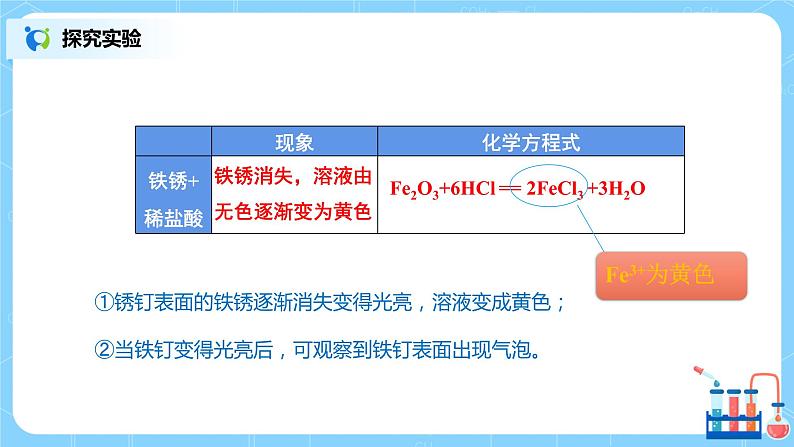
2.取两个生锈的铁钉放入两支试管中,然后加入约2mL稀盐酸,观察现象。当观察到铁钉表面的锈去掉变得光亮时,将其中一支试管中的铁钉取出,洗净。继续观察另一支试管中的现象,过一段时间将铁钉取出,洗净。比较两支铁钉。
温馨提示:1、稀盐酸、稀硫酸具有一定的腐蚀性,使用时要十分小心,防止沾到皮肤上;2、如果不说明用量,液体取1-2 mL 为宜。
①锈钉表面的铁锈逐渐消失变得光亮,溶液变成黄色;②当铁钉变得光亮后,可观察到铁钉表面出现气泡。
铁锈消失,溶液由无色逐渐变为黄色
Fe2O3+6HCl == 2FeCl3 +3H2O
想一想:将铁钉放入试管时应如何操作?(联系取用固体药品)
想一想: 实验时除观察到铁锈逐渐消失,溶液由无色慢慢变成黄色,当铁锈消失以后,还会看到铁钉表面会冒出气泡。为什么?除锈时能否将铁制品长时间浸在酸中?
当长时间浸泡时,与铁锈反应剩余的酸就会继续与铁反应生成氢气,除锈时不能长时间浸泡。
酸的化学性质1、跟指示剂的反应2、跟金属的反应3、跟金属氧化物的反应4、跟碱的反应5、跟某些盐反应
已知鸡蛋壳的主要成分是碳酸钙,知识回忆
CaCO3+2HCl=CaCl2+H2O+CO2↑
3.在试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察现象。①出现蓝色絮状沉淀,溶液变成无色。然后再向试管中加入稀盐酸,观察现象。 ②蓝色絮状沉淀溶解,溶液呈蓝绿色。
根据实验总结氢氧化钙的性质:1.碱溶液能使紫色的石蕊溶液变蓝色,使无色的酚酞溶液变红色。2.氢氧化钙微溶于水。3.氢氧化钙溶液与盐酸反应。Ca(OH)2+CO2=CaCO3↓+H2O(检验CO2)
(1)碱溶液与指示剂的作用
(2)碱溶液和二氧化碳等非金属氧化物反应
2NaOH + CO2 = Na2CO3 + H2O
Ca(OH)2+CO2= CaCO3↓+H2O (检验CO2)
氢氧化钠放置在空气中会发生变质,所以氢氧化钠必须密封保存。
(3)碱溶液和酸反应生成盐和水
NaOH + 2HCl = NaCl2+ H2O
相关课件
这是一份人教版九年级下册实验活动6 酸、碱的化学性质教课课件ppt,共23页。PPT课件主要包含了学习目标,变红色,变蓝色,不变色无色,金属氧化物,非金属氧化物,变成蓝色,变成红色,生锈的铁钉与盐酸,铁钉变光亮时取出等内容,欢迎下载使用。
这是一份人教版九年级下册实验活动7 溶液酸碱性的检验习题ppt课件,共20页。PPT课件主要包含了蓝色沉淀消失,澄清液体,澄清石灰水,浓盐酸合理即可,含酚酞的氢氧化,钠溶液合理即可,稀硫酸,氢氧化钠溶液,氢氧化钙等内容,欢迎下载使用。
这是一份初中人教版实验活动7 溶液酸碱性的检验获奖习题课件ppt,文件包含化学人教版九年级下册第十单元《实验活动7溶液酸碱性的检验》课件pptx、化学人教版九年级下册第十单元《实验活动7溶液酸碱性的检验》同步练习docx、化学人教版九年级下册第十单元《实验活动7溶液酸碱性的检验》教案docx等3份课件配套教学资源,其中PPT共18页, 欢迎下载使用。












