



人教版 (2019)必修 第二册第一节 化学反应与能量变化多媒体教学ppt课件
展开
这是一份人教版 (2019)必修 第二册第一节 化学反应与能量变化多媒体教学ppt课件,共36页。PPT课件主要包含了放热反应与吸热反应,知识点一,旧化学键的断裂,新化学键的形成,化学键,放出热量的化学反应,吸收热量的化学反应,能源综合利用,知识点二,石油天然气等内容,欢迎下载使用。
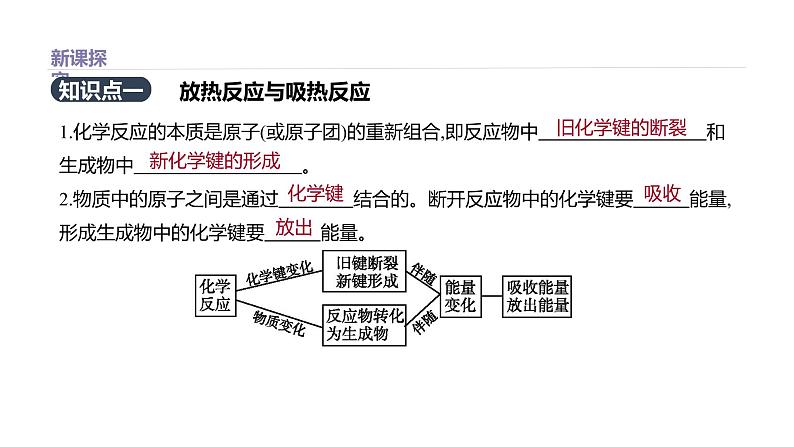
1.化学反应的本质是原子(或原子团)的重新组合,即反应物中 和生成物中 。 2.物质中的原子之间是通过 结合的。断开反应物中的化学键要 能量,形成生成物中的化学键要 能量。
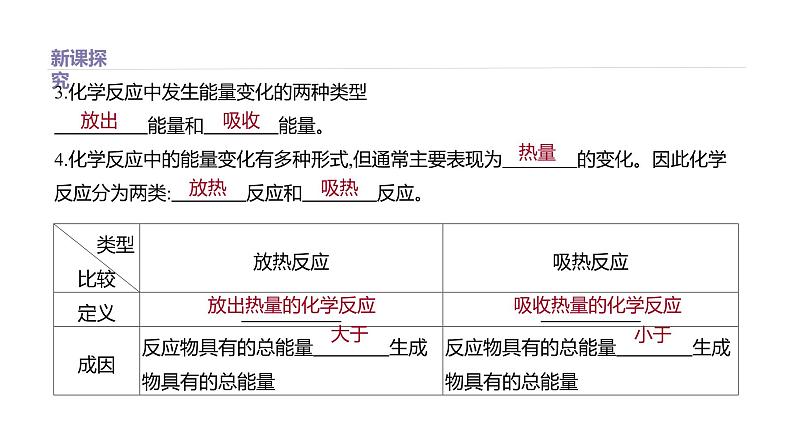
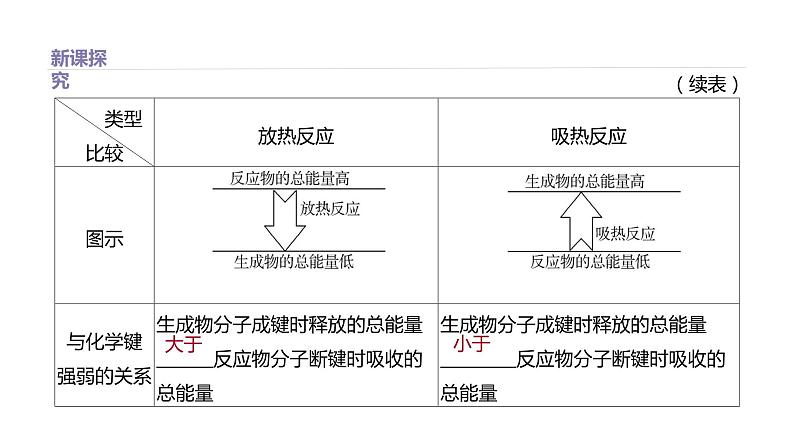
3.化学反应中发生能量变化的两种类型 能量和 能量。 4.化学反应中的能量变化有多种形式,但通常主要表现为 的变化。因此化学反应分为两类: 反应和 反应。
[素养养成] 1.化学反应过程都伴随着能量变化,伴随能量变化的过程都是化学反应吗?
[答案]提示:不一定,如核反应、物质三态变化都有能量变化,但它们不属于化学反应。
2.NaOH溶于水放出热量,NaOH溶于水是放热反应吗?
[答案] 提示:吸热反应和放热反应均是化学反应。注意明确某些吸热过程和放热过程不属于化学反应。如:NaOH固体溶于水、浓硫酸稀释属于放热过程,NH4NO3固体溶于水属于吸热过程,三者都不是化学反应,也就不属于吸热反应或放热反应。
3.NaCl溶于水,化学键有没有变化?如果仅从化学键角度分析,NaCl溶于水是吸热还是放热?
[答案] 提示:NaCl溶于水发生电离NaCl=Na++Cl-,只有化学键断裂,没有化学键形成;仅从化学键角度分析,NaCl溶于水吸热。
4.一种形式的能量转化为另一种形式的能量,转化的途径和能量形式不同,但体系总能量是否不变?
[答案] 提示:不变,能量是守恒的。
例1 下列说法中正确的是 ( )A.物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化B.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应C.吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多D.因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
[解析] A项,化学反应发生的过程中都有能量变化,但有能量变化的不一定是化学变化,也可能是物理变化,如水蒸气变成液态水的过程是放热过程,但它是物理变化。B项,一个反应是吸热反应还是放热反应和反应条件没有必然的联系,如碳燃烧需要 加热,但此反应为放热反应;氢氧化钡与氯化铵的反应是吸热反应,不需要加热也能 自发进行。C项,一个反应是吸热反应,从宏观来看,说明反应物的总能量比生成物的总能量低;从微观来看,旧键断裂吸收的能量比新键形成放出的能量多。D项,因为3O2=2O3为吸热反应,臭氧具有的能量比氧气的能量高,所以臭氧比氧气活泼。
例2 下列反应既属于氧化还原反应,又属于吸热反应的是 ( )A.锌粒与稀硫酸的反应B.灼热的木炭与CO2反应C.甲烷在氧气中的燃烧反应D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
[解析] 锌粒与稀硫酸的反应、甲烷的燃烧反应均是放热反应,不合题意;Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是吸热反应,但元素的化合价无变化,是一个非氧化还原反应,D项不合题意。
[易错警示] 化学反应吸收或放出能量的判断(1)各种物质都储存有化学能,不同的物质所储存的化学能不同。化学反应中,物质发生了变化,化学能也随之而改变,化学反应过程中吸收或放出能量可用如图形象地表示:
(2)吸热反应与放热反应的判断方法根据反应类型判断:①化合反应一般为放热反应;②需要加热的分解反应一般为吸热反应;③中和反应为放热反应。记住一些特殊反应:①Ba(OH)2·8H2O晶体和NH4Cl晶体反应吸热;②所有的燃烧反应都是放热反应;③活泼金属与水或酸的反应为放热反应。
人类利用能源的三个阶段1.柴草时期该时期从火的发现至18世纪产业革命,以树枝杂草为主要能源。2.化石能源时期从18世纪中期到现代,以 为主要能源。 3.多能源结构时期以 能源和 能源(绿色能源)为主要能源,主要包括 、 、生物质能等。
[素养养成] 加热条件下进行的反应是否一定是吸收能量的反应,常温下进行的反应是否一定是释放能量的反应?
[答案]提示:化学反应放热还是吸热取决于化学键断裂吸收的能量与化学键形成放出的能量的相对大小,与反应条件无关。
例3 下列关于能源利用的说法中正确的是( )A.贮氢材料在使用中,氢分子被吸收时,在合金表面解离变成氢原子,同时放出热量B.对城市废弃物进行处理后焚烧,利用产生的热能供暖和发电C.使用化石燃料不会带来环境污染问题D.将氢气作为燃料使用的优点之一是成本低
[解析] 氢分子变成原子的过程是化学键断裂的过程,属于吸热过程,A项错误;对城市废弃物的处理方式主要是焚烧,利用产生的热能供暖和发电,B项正确;化石燃料在使用过程中往往会造成一定的环境污染问题,C项错误;氢气的主要来源是水,由水制得氢气的成本较高,所以推行进度缓慢,D项错误。
例4 能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源的能量间接制取的能源称为二级能源。据此判断,下列叙述正确的是( )A.天然气是二级能源B.石油是二级能源C.电能是一级能源D.水流是一级能源
[解析] 根据定义,天然气、石油、水流是自然界中存在的,都是一级能源,电能由其他能转化而来,是二级能源。
(2)一次能源与二次能源对比
1.下列对化学反应的认识错误的是( )A.会引起化学键的变化B.会产生新的物质C.必然引起物质状态的变化D.必然伴随着能量的变化
[解析] 化学反应的本质是化学键的断裂和形成,表现为有新物质生成,并伴随着能量的变化,而化学变化中的反应物和生成物的状态在反应前后可能相同,也可能不相同。
2.对于化学反应中的能量变化,表述正确的是( )A.断开化学键的过程会放出能量B.加热才能发生的反应一定是吸热反应C.吸热反应中,反应物的总能量小于生成物的总能量D.放热反应不需要加热就能反应
[解析] 断开化学键即破坏化学键,需要吸收能量,A错误;吸热反应不一定需要加热才能发生,如NH4Cl和Ba(OH)2·8H2O的反应就是吸热的,加热才能发生的反应不一定是吸热反应,如铝热反应,故B、D错误;当反应物的总能量大于生成物的总能量时,该反应是放热反应,反之,该反应为吸热反应,故C正确。
3.图中,能表示灼热的炭与二氧化碳反应的能量变化的是 ( )
A BC D
[解析] C和CO2反应生成CO是吸热反应,生成物总能量应大于反应物总能量。
4.“能源分类相关图”如图所示,四组能源选项中全部符合图中阴影部分的能源是 ( )A.煤炭、石油、潮汐能B.水能、生物质能、天然气C.太阳能、风能、沼气D.地热能、海洋能、核能
[解析] A项,煤炭、石油不是新能源,也不是可再生能源;B项,天然气不是新能源,也不是可再生能源;D项,地热能是来自地球内部的能源,核能不是可再生能源,也不是来自太阳的能源。
5.研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化。据此判断以下叙述中错误的是 ( )A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低B.物质燃烧可看作是储存在物质内部的能量(化学能)转化为热能释放出来C.氮气分子内部存在着很强的化学键,故通常情况下氮气的化学性质很活泼D.需要加热才能发生的反应不一定是吸收能量的反应
6.氢气是未来的理想能源,理由是 ( )①热值高 ②燃烧时不污染环境 ③用于制取H2的水资源丰富 ④密度小,便于运输A.①②③B.②③④C.①③④D.①②③④
[解析] 解决氢能源的难题一个是制备困难,另一个是运输困难。
7.将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是 ( )①使煤充分燃烧,提高煤的利用率 ②减少SO2的产生,避免造成“酸雨” ③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”A.①②③ B.②③④ C.①③④ D.①②③④
[解析] 煤块粉碎是为了提高煤的利用率;脱硫是为了减少SO2的产生;过量空气是为了减少CO的产生。
8.下列反应中,属于放热反应的是 ,属于吸热反应的是 (填序号)。 ①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO) ②燃烧蜂窝煤取暖 ③炸药爆炸 ④硫酸与氢氧化钾溶液反应 ⑤生石灰与水作用制熟石灰 ⑥食物腐败⑦碳与水蒸气反应制得水煤气
[解析] 燃烧反应都是放热反应,部分以C、H2、CO为还原剂的氧化还原反应为吸热反应。
1.已知2SO2+O2 2SO3为放热反应,对该反应的下列说法正确的是( )A.O2的能量一定高于SO2的能量B.SO2和O2的总能量一定高于SO3的总能量C.SO2的能量一定高于SO3的能量D.因该反应为放热反应,故不必加热就可发生
[解析] 判断一个反应是放热反应还是吸热反应,关键看反应物的总能量与生成物的总能量的差值。如果反应物的总能量高于生成物的总能量,反应放热,B项正确;A项和C项错误;放热反应只表明反应物总能量比生成物总能量高,而加热是反应的条件,两者无必然联系,许多放热反应也必须加热才能开始进行,D项错误。
2.石墨和金刚石都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12 g石墨完全转化为金刚石时,要吸收a kJ的能量。下列说法中正确的是( )①石墨不如金刚石稳定②金刚石不如石墨稳定③等质量的石墨和金刚石完全燃烧,金刚石放出的能量多④等质量的石墨和金刚石完全燃烧,石墨放出的能量多A.①② B.②③ C.①④ D.③④
[解析]由石墨完全转化为金刚石时吸热,说明石墨的能量比金刚石低,石 墨比金刚石更稳定;同质量的石墨和金刚石完全燃烧时,消耗氧气的量相同,生成同样多的二氧化碳,由于金刚石的能量高,所以金刚石燃烧后放出的 能量要多。
3.已知1 g氢气完全燃烧生成水蒸气时放出能量121 kJ,且氧气中1 ml O=O键完全断裂时需要吸收能量496 kJ,水蒸气中1 ml H—O键形成时放出能量463 kJ,则氢气中 1 ml H—H键断裂时吸收能量为( )A.920 kJ B.557 kJC.436 kJ D.188 kJ
4.向盛有50 mL 1.00 ml·L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是 ( )A.该实验表明化学能可以转化为热能B.NaOH溶液的浓度大于1.00 ml·L-1C.V=50 mL时,混合液呈碱性D.该实验表明有水生成的反应都是放热反应
[解析]分析图像知:随着反应进行,混合液的温度升高,所以该反应为放热反应,化学能转化为热能,A项正确;当V(NaOH)=40 mL时,反应使混合液达到最高温度,所以此时HCl被恰好中和,故NaOH溶液的浓度大于1.00 ml·L-1,而加入50 mL NaOH溶液时,NaOH过量,溶液应呈碱性,B、C两项正确;D选项错误,例如,Ba(OH)2·8H2O与NH4Cl的反应生成水,但该反应是吸热反应。
5.太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下某种盐熔化,吸收热量,晚间熔盐固化释放出相应的能量,已知数据:其中最适宜作为储能介质的是 ( )A.CaCl2·6H2O B.Na2SO4·10H2OC.Na2HPO4·12H2O D.Na2S2O3·5H2O
[解析]该盐应是熔点不能太高,熔化吸热应较高,价格适中。
6.断开1 ml H—H键、1 ml N—H键、1 ml N≡N键分别需要吸收的能量为436 kJ、391 kJ、946 kJ。求:(1)1 ml N2完全反应生成NH3需 (填“吸收”或“放出”)能量 kJ。
相关课件
这是一份高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化教课内容ppt课件,共39页。PPT课件主要包含了原电池工作原理,知识点一,氧化还原,活动性不同,电解质,氧化反应,还原反应,铜或石墨,FeCl3溶液,常见化学电源等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化课文配套课件ppt,共57页。PPT课件主要包含了必备知识·自主学习,逐渐溶解,刺激性,化学键的断裂和形成,对大小,不可再生,SO2,NOx,燃烧效率,能源利用等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第一节 化学反应与能量变化背景图ppt课件,共57页。PPT课件主要包含了必备知识·自主学习,化学能转化为热能,汽化为蒸汽,逐渐溶解,发生改变,2工作原理分析,石墨棒,二次电池,发展中的燃料电池,关键能力·合作学习等内容,欢迎下载使用。










