
人教版 (2019)必修 第二册第一节 硫及其化合物第3课时学案
展开
这是一份人教版 (2019)必修 第二册第一节 硫及其化合物第3课时学案,共7页。
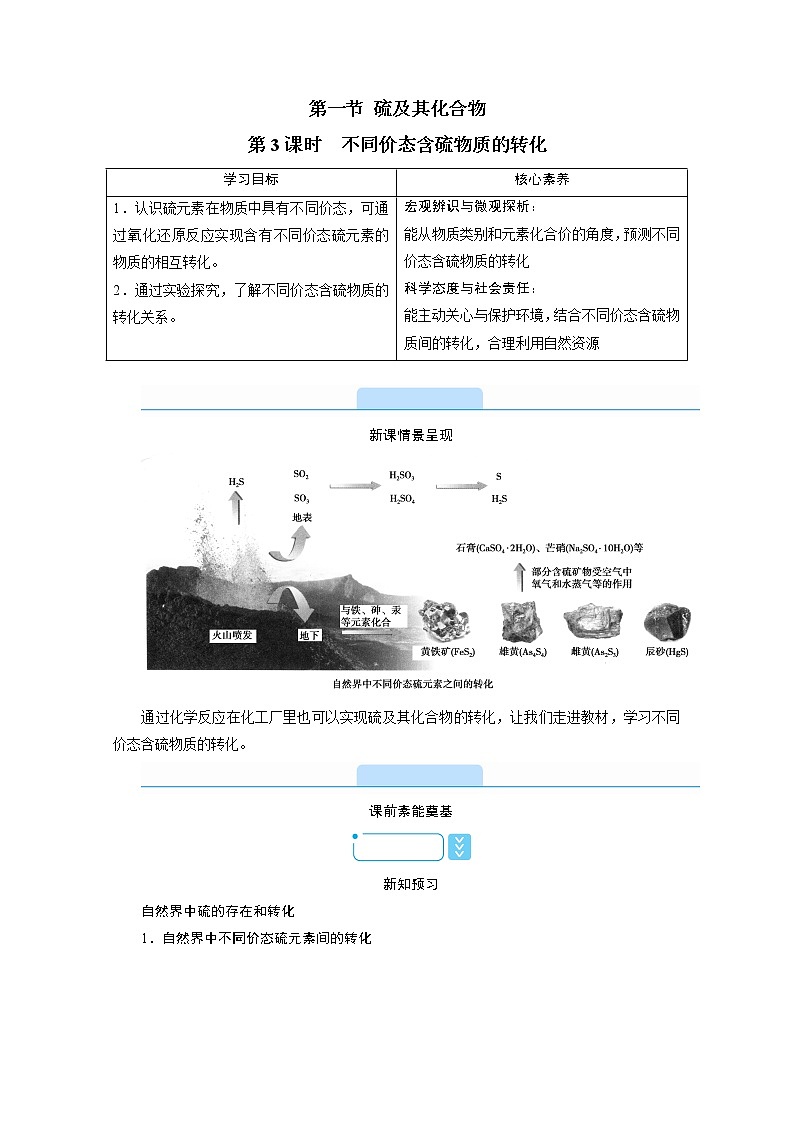
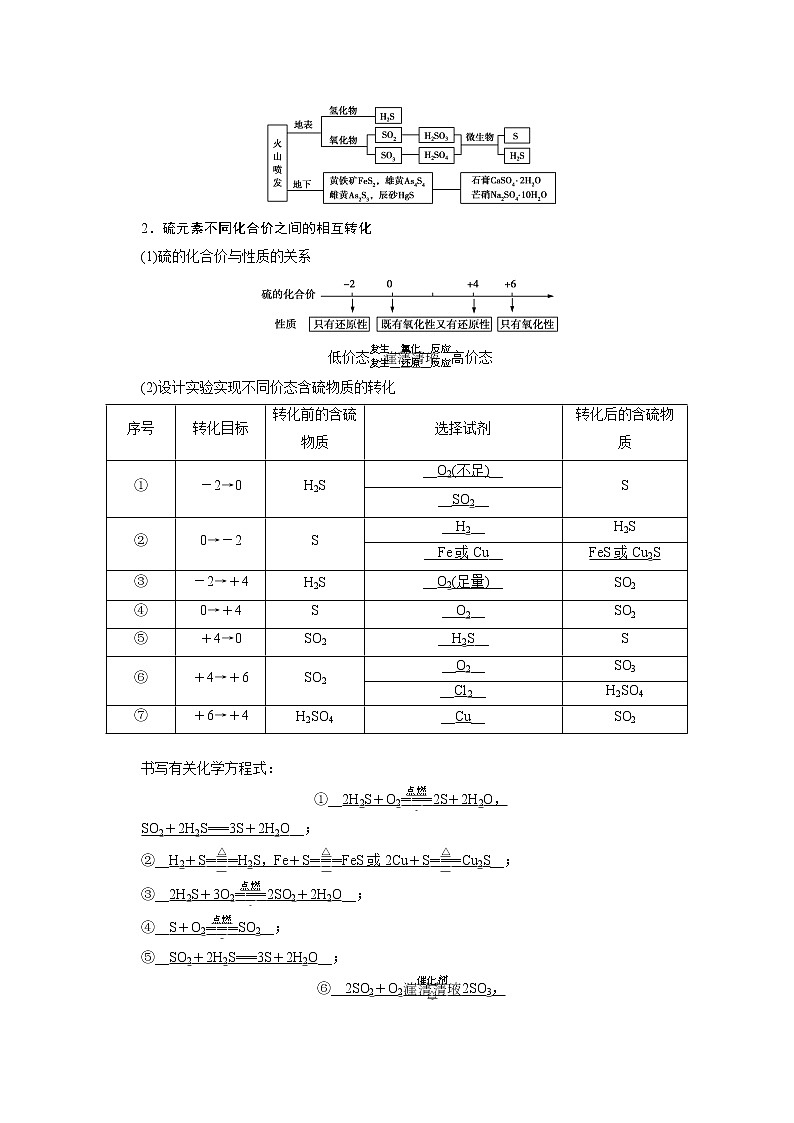
第一节 硫及其化合物第3课时 不同价态含硫物质的转化学习目标核心素养1.认识硫元素在物质中具有不同价态,可通过氧化还原反应实现含有不同价态硫元素的物质的相互转化。2.通过实验探究,了解不同价态含硫物质的转化关系。 宏观辨识与微观探析:能从物质类别和元素化合价的角度,预测不同价态含硫物质的转化科学态度与社会责任:能主动关心与保护环境,结合不同价态含硫物质间的转化,合理利用自然资源 新课情景呈现通过化学反应在化工厂里也可以实现硫及其化合物的转化,让我们走进教材,学习不同价态含硫物质的转化。课前素能奠基新知预习自然界中硫的存在和转化1.自然界中不同价态硫元素间的转化2.硫元素不同化合价之间的相互转化(1)硫的化合价与性质的关系低价态高价态(2)设计实验实现不同价态含硫物质的转化序号转化目标转化前的含硫物质选择试剂转化后的含硫物质①-2→0H2S__O2(不足)__S__SO2__②0→-2S__H2__H2S__Fe或Cu__FeS或Cu2S③-2→+4H2S__O2(足量)__SO2④0→+4S__O2__SO2⑤+4→0SO2__H2S__S⑥+4→+6SO2__O2__SO3__Cl2__H2SO4⑦+6→+4H2SO4__Cu__SO2 书写有关化学方程式:①__2H2S+O22S+2H2O,SO2+2H2S===3S+2H2O__;②__H2+SH2S,Fe+SFeS或2Cu+SCu2S__;③__2H2S+3O22SO2+2H2O__;④__S+O2SO2__;⑤__SO2+2H2S===3S+2H2O__;⑥__2SO2+O22SO3,SO2+Cl2+2H2O===2HCl+2H2SO4__;⑦__Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑__。预习自测1.判断下列说法是否正确(正确的打“√”,错的打“×”)(1)硫在过量、纯净的O2中燃烧的产物是SO3。( × )(2)将SO2通入氢硫酸中,若出现淡黄色浑浊,则证明SO2具有氧化性。( √ )(3)在反应H2S+H2SO4(浓)===S↓+SO2↑+2H2O中,氧化产物为SO2,还原产物为S。( × )解析:(1)硫与O2反应的产物是SO2而不是SO3。(2)将SO2通入氢硫酸中,发生反应SO2+2H2S===3S↓+2H2O,SO2表现氧化性。(3)根据氧化还原反应规律分析反应H2S+H2SO4(浓)===S失2e-↓+S得2e-O2↑+2H2O,氧化产物为S,还原产物为SO2。2.下列转化不能一步实现的是( B )A.S→H2S B.S→SO3C.H2SO4→SO2 D.Na2SO3→SO2解析:H2+SH2S,A不选;S和O2反应只能生成SO2,选B;浓硫酸和还原性物质反应生成SO2,C不选;Na2SO3与浓H2SO4反应生成SO2,D不选。3.下列离子方程式或化学方程式正确的是( A )A.SO2通入少量NaClO溶液中:SO2+ClO-+H2O===SO+Cl-+2H+B.足量的SO2通入Na2CO3溶液中:CO+SO2===CO2+SOC.铁与硫混合加热:2Fe+3SFe2S3D.浓硫酸与FeS混合:FeS+H2SO4(浓)===FeSO4+H2S↑解析:SO2通入少量NaClO溶液中,发生氧化还原反应,反应的离子方程式为:SO2+ClO-+H2O===SO+Cl-+2H+,A项正确;足量SO2通入Na2CO3溶液中,离子方程式为:CO+H2O+2SO2===CO2↑+2HSO,B项错误;铁与硫混合加热生成FeS,C项错误;浓硫酸与FeS混合,二者发生氧化还原反应,正确的化学方程式为:2FeS+10H2SO4(浓)===Fe2(SO4)3+10H2O+9SO2↑,D项错误。4.在古代中国,稀硫酸被称为“绿矾油”。《黄帝九鼎神丹经诀》卷九中就记载着“炼石胆取精华法”,即干馏石胆(胆矾)而获得硫酸。绿矾油是一种无色黏稠液体,可用于除掉兵器上的铁锈。实验室模拟此过程:可以用FeSO4·7H2O加强热,用加冰水混合物的U形管冷凝即可,用NaOH吸收SO2理论可得29.5%的H2SO4。(1)上述过程硫的化合价如何变化?你能预测生成的含铁化合物是什么吗?__反应中有硫酸和SO2生成,故硫的化合价降低;由氧化还原反应的规律可知铁的化合价一定升高,故产物为Fe2O3。__(2)试写出反应的化学方程式。__2FeSO4·7H2OFe2O3+SO2↑+SO3↑+14H2O,SO3+H2O===H2SO4。__5.大型节日时,人们经常会燃放烟花爆竹等。但这会带来很大的空气污染,近几年,越来越多的城市全年全区域禁止燃放烟花爆竹。(1)燃放爆竹时的主要反应是S+2KNO3+3C===K2S+3CO2↑+N2↑,S发生了什么变化?表现什么性质?__反应中S的化合价降低,发生还原反应,表现氧化性。__(2)燃放爆竹时会闻到强烈的刺激性气味,你知道其中的原因吗?__燃放爆竹时S与空气中的氧气反应生成有刺激性气味的SO2气体。__课堂素能探究不同价态含硫物质的转化,知识点问题探究把SO2气体通入BaCl2溶液中,产生了白色沉淀,该沉淀的成分是什么?请解释原因。提示:白色沉淀为BaSO4。SO2气体通入BaCl2溶液中,不会直接与BaCl2反应,SO2与水反应生成H2SO3,H2SO3被氧气氧化为H2SO4,H2SO4与BaCl2反应生成BaSO4沉淀。知识归纳总结1.常见含硫的物质的转化2.不同价态硫的化合物的转化(1)价态与性质①-2价硫处于最低价态,只有还原性,可被O2、Cl2等氧化剂氧化为S;②0价、+4价硫处于中间价态,既有氧化性又有还原性;③+6价硫处于最高价态,只有氧化性。注意浓硫酸在一定条件下与金属或还原性盐反应时既体现强氧化性又体现酸性,如Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑。(2)价态变化规律当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降,如:H2 O2 O3(3)含硫物质的连续氧化硫元素┃┃典例剖析__■ 典例 亚硫酸钠中+4价的硫既有氧化性又有还原性。现有试剂:氯水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、氢氧化钠溶液。(1)要证明亚硫酸溶液具有还原性,应选用什么试剂?会观察到什么现象?写出反应的离子方程式。__氯水 氯水褪色 H2SO3+Cl2+H2O===SO+2Cl-+4H+__(2)要证明亚硫酸钠溶液具有氧化性,应选用什么试剂?会观察到什么现象?写出反应的离子方程式。__硫化钠溶液、稀硫酸 有淡黄色沉淀生成 6H++SO+2S2-===3S↓+3H2O__(3)如何通过实验证明亚硫酸钠已被氧化?实验操作步骤实验操作和实验现象①__取少量亚硫酸钠溶液于试管中,加足量盐酸酸化,未见白色沉淀产生__②__再加少量BaCl2溶液,如果出现白色沉淀,则亚硫酸钠已被氧化__ 解析:根据氧化还原反应的特点,要证明Na2SO3有氧化性,则应加入还原性试剂,反之,要加入氧化性试剂。Na2SO3与Na2S在酸性条件下反应生成单质S,碱性条件下不反应。通过验证亚硫酸钠溶液中是否含有SO,即可确定其是否被氧化。 ┃┃变式训练__■ 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( D )A.X使蔗糖变黑的现象主要体现了X的强氧化性B.若A为铁,则足量A与X在室温下即可完全反应C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到有白色沉淀产生D.工业上,B转化为D的反应条件为高温、常压、使用催化剂解析:X使蔗糖变黑的现象主要体现了X的脱水性,A项错误;若A是铁,常温下,铁与浓硫酸发生钝化现象,所以铁不能完全溶解,B项错误;若A是碳,浓硫酸和碳反应生成CO2、SO2和H2O,CO2和少量澄清石灰水可能生成易溶于水的Ca(HCO3)2,而观察不到白色沉淀C项错误;工业上,SO2转化成SO3的反应条件为高温、常压、使用催化剂,D项正确。名师博客呈现巧用转化关系模型图进行物质之间连续转化的推断1.直线型转化关系S(固体)SO2SO3H2SO4或H2SS(固体)SO2SO3H2SO42.交叉型转化关系图3.三角型转化关系〔即时训练〕在下列反应中硫元素只表现氧化性的是( A )A.2Al+3SAl2S3B.S+2H2SO4(浓)2H2O+3SO2↑C.H2SH2+SD.3S+6NaOH2Na2S+Na2SO3+3H2O解析:A项,该反应中S元素的化合价由0价变为-2价,只体现氧化性,正确;B项,该反应中S元素的化合价由0价、+6价变为+4价,S元素体现了氧化性和还原性,错误;C项,该反应中S元素的化合价由-2价变为0价,S元素只体现还原性,错误;D项,该反应中S元素的化合价由0价变为-2价、+4价,S元素体现氧化性和还原性,错误。
相关学案
这是一份人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物第二课时学案,共5页。学案主要包含了教学目标,教学重难点,课后练习等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物第1课时学案,共11页。学案主要包含了二氧化硫等内容,欢迎下载使用。
这是一份化学人教版 (2019)第一节 硫及其化合物第2课时学案,共12页。学案主要包含了硫酸,SOeq \\al的检验等内容,欢迎下载使用。









