
所属成套资源:2022届高考化学一轮复习教案
2022高考化学一轮复习教案:第1章 第3讲 一定物质的量浓度溶液的配制
展开
这是一份2022高考化学一轮复习教案:第1章 第3讲 一定物质的量浓度溶液的配制,共10页。
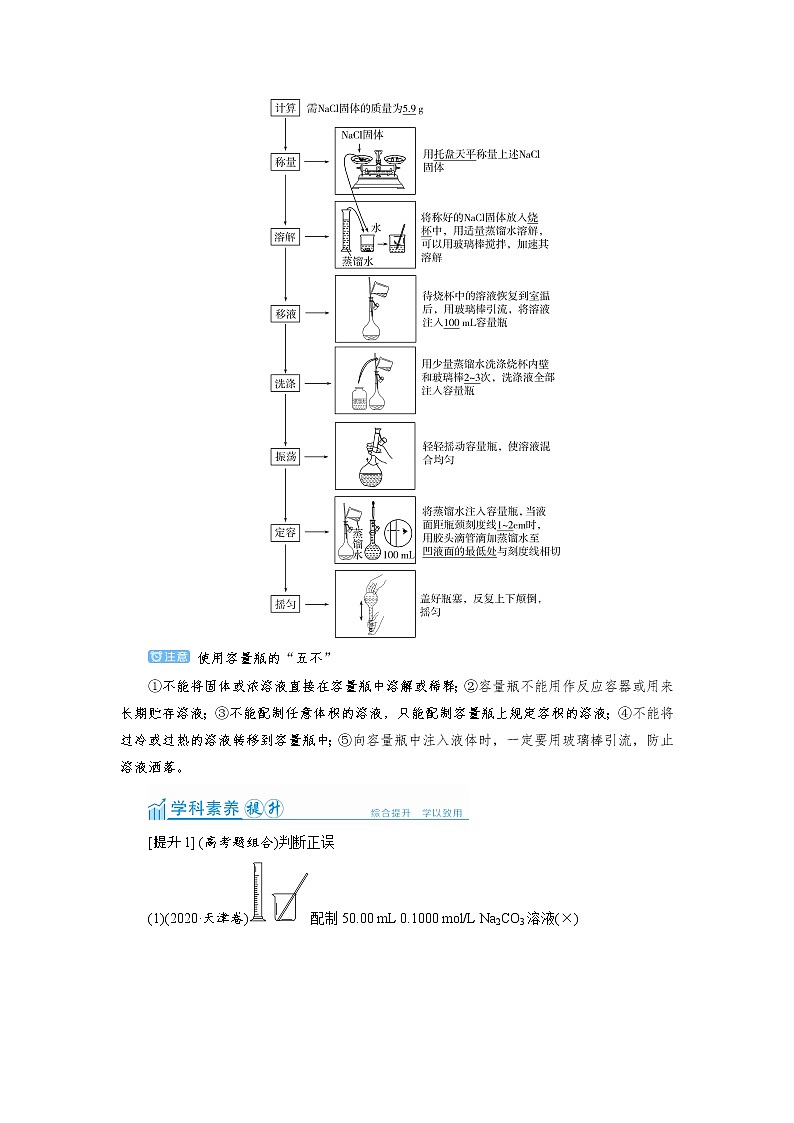
第3课时 学科素养——一定物质的量浓度溶液的配制素养1 实践探索 一定物质的量浓度溶液的配制“实践探索”包括认知操作和行动操作两个方面,是个体改造世界的核心品质。“实践探索”是信息输入和认知加工之后的必然结果,是完成认知学习和实践的关键环节。一定物质的量浓度溶液的配制实验体现实践探索中是“研究探索”、“操作运用”,要求能够根据实验目的和要求,设计合理的实验方案,进行正确的实验操作,科学收集、处理并解释实验数据;能够根据方案的实践结果不断修正和改进方案;能够运用口头语言和书面语言进行沟通交流,准确表达自己的看法,通过合作解决问题。1.两种重要仪器——托盘天平和容量瓶(1)托盘天平的构造及使用称量前先调零,称量固体药品时,药品放在左盘,砝码放在右盘,读数精确到0.1 g。(2)容量瓶的构造及使用(3)容量瓶的查漏操作2.一定物质的量浓度溶液的配制流程(1)主要仪器:托盘天平、药匙、量筒、烧杯、容量瓶、玻璃棒、胶头滴管等。(2)配制过程(以配制100 mL 1.0 mol·L-1 NaCl溶液为例): 使用容量瓶的“五不”①不能将固体或浓溶液直接在容量瓶中溶解或稀释;②容量瓶不能用作反应容器或用来长期贮存溶液;③不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液;④不能将过冷或过热的溶液转移到容量瓶中;⑤向容量瓶中注入液体时,一定要用玻璃棒引流,防止溶液洒落。[提升1] (高考题组合)判断正误(1)(2020·天津卷)配制50.00 mL 0.1000 mol/L Na2CO3溶液(×)(2)(2019·天津卷)配制一定浓度的溶液,如图(√)(3)(2019·江苏卷)将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度线,配制1.000 mol·L-1 NaOH溶液(×)(4)(2018·全国卷Ⅱ)配制0.400 0 mol·L-1 的NaOH溶液:称取4.0 g 固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250 mL 容量瓶中定容(×)(5)(2017·全国卷Ⅲ)配制浓度为0.010 mol·L-1的KMnO4溶液:称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度(×)[提升2] (人教必修1·P18,6题改编)某同学用容量瓶配制溶液,加水时超过了刻度线,他(她)把水倒出一些,重新加水至刻度线。下列有关说法中不正确的是( )A.所配溶液的浓度不变 B.所配溶液的浓度偏低C.倒出的水中含有溶质 D.该操作错误,应重新配制A [用容量瓶配制溶液,加水时超过了刻度线,倒出的水中含有溶质,引起溶质的损失,故所配溶液的浓度偏低,该操作错误,应重新配制溶液。][提升3] (1)(2020·全国卷Ⅰ,27题节选)由FeSO4·7H2O固体配制0.10 mol·L-1 FeSO4溶液,需要的仪器有药匙、玻璃棒、________________(从下列图中选择,写出名称)。(2)(2017·全国卷Ⅱ,28题节选)Na2SO3溶液常用作标准溶液滴定I2(2S2O+I2===2I-+S4O),但Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和___________________________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除________及二氧化碳。解析 (1)配制0.10 mol·L-1 FeSO4溶液,用托盘天平称取FeSO4·7H2O晶体,放入烧杯中,用量筒量取一定体积的蒸馏水溶解,再转移到容量瓶中进行定容。(2)一定物质的量浓度溶液的配制还需要容量瓶和量筒;加热可以除去溶液的氧气,避免实验结果不准确。答案 (1)烧杯、量筒、托盘天平 (2)量筒、容量瓶 氧气[提升4] 实验室需要配制0.50 mol·L-1NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。(1)选择仪器。完成本实验必需用到的仪器有:托盘天平(带砝码、最小砝码为5 g)、药匙、烧杯、________、______、________以及等质量的两片滤纸。(2)计算。配制该溶液需取NaCl晶体________g。(3)称量。①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置;②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。③称量完毕,将药品倒入烧杯中。(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是__________________________________________________________________________________________________。(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了__________________________________________________________。(6)定容。向容量瓶中加水至液面接近刻度线______处,改用________加水,使溶液凹液面与刻度线相切。(7)摇匀、装瓶。解析 配制480 mL 0.50 mol·L-1的NaCl溶液,必须用500 mL的容量瓶。m(NaCl)=0.50 mol·L-1×0.5 L×58.5 g·mol-1≈14.6 g(托盘天平精确到0.1 g)。用托盘天平称量时,物品放在左盘。配制一定物质的量浓度溶液的一般步骤为计算→称量(或量取)→溶解(或稀释)、冷却→转移、洗涤→定容、摇匀→装瓶贴签。答案 (1)500 mL容量瓶 胶头滴管 玻璃棒 (2)14.6(3)①②左盘 (4)搅拌,加速NaCl溶解 (5)保证溶质全部转入容量瓶中 (6)1~2 cm 胶头滴管素养2 思维方法 一定物质的量浓度溶液配制中的误差分析“思维方法”是思维的品质、方式和能力的综合,是个体高质量地解决生活实践或学习探索情境中的各种问题的基础。“思维方法”是认知加工的关键构件,是个体在信息时代所必须具备的核心认知品质,也是未来社会人才所需要的终身素养。一定物质的量浓度配制的误差分析过程体现思维方法中的“科学思维”,要求能够根据对问题情境的分析,运用实证数据分析事物的内部结构和问题的内在联系,以抽象的概念来反映客观事物的本质特征和内在联系。1.误差分析的基本方法误差分析中变量是m或V,一般情况要固定其一,分析另一物理量的变化对溶液浓度的影响:2.配制溶液过程中不当操作引起的误差仪器使用引起误差的不当操作因变量c/mol·L-1m(溶质)V(溶液)托盘天平①天平的砝码生锈或粘有固体增大不变偏大②称量易潮解的物质时间过长或用称量纸称易潮解的物质(如NaOH固体)减小不变偏小量筒①量取液体时,仰视刻度线读数增大不变偏大②量取液体时,俯视刻度线读数减小不变偏小烧杯及玻璃棒①搅拌时,部分液体溅出减小不变偏小②未洗涤烧杯和玻璃棒,或洗涤液未注入容量瓶中减小不变偏小容量瓶①未冷却到室温便注入容量瓶定容不变减小偏大②从烧杯向容量瓶转移溶液时,有少量液体洒落减小不变偏小③定容时,加蒸馏水超过了刻度线,再用胶头滴管吸出多余液体减小不变偏小④定容后,轻轻振荡、摇匀、静置,液面下降再加蒸馏水不变增大偏小⑤定容时,俯视刻度线不变减小偏大⑥定容时,仰视刻度线不变增大偏小[提升5] 欲配制100 mL 1.0 mol·L-1 Na2SO4溶液,下列操作会使配得的溶液浓度偏小的是( )A.容量瓶中原有少量蒸馏水B.定容时,俯视容量瓶中液体的凹液面C.称量Na2SO4固体时,药品和砝码的位置放反了(1 g以下用游码)D.将32.2 g Na2SO4·10H2O溶于少量水中,再配制成100 mL 溶液C [定容时要加入蒸馏水,因此容量瓶中原有少量蒸馏水,所得溶液的浓度不变,A项错误;定容时,俯视容量瓶中液体的凹液面,定容结束时,液面低于刻度线,则所得溶液的浓度偏大,B项错误;称量Na2SO4固体时,物质与砝码位置放反了,且1 g以下用游码,则称取Na2SO4固体的质量减小,故所配得溶液的浓度偏小,C项正确;32.2 g Na2SO4·10H2O的物质的量为0.1 mol,溶于少量水中配成100 mL溶液,则有c(Na2SO4)=0.1 mol/0.1 L=1.0 mol·L-1,D项错误。][提升6] (2021·河南郑州检测)某学生配制了100 mL 1 mol·L-1的硫酸,然后对溶液浓度做精确测定,且测定过程中一切操作都正确,但测得溶液的物质的量浓度小于1 mol·L-1。则在配制过程中,下列操作可能导致溶液浓度偏低的是( )①用量筒量取浓硫酸后,再用蒸馏水洗涤量筒,并将洗涤液转移到容量瓶中;②将浓硫酸在烧杯中稀释,转移到100 mL的容量瓶中后,没有洗涤烧杯;③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面;④最后定容时,加水超过了刻度线,马上用胶头滴管吸去多余的水,使溶液凹液面最低处刚好与刻度线相切。A.只有②③④ B.只有③④C.只有①②③ D.①②③④A [①用量筒量取浓硫酸,不需要用蒸馏水洗涤量筒,若洗涤且将洗涤液转移到容量瓶中,所取溶质H2SO4偏多,导致溶液浓度偏高,错误。②未洗涤烧杯,使溶质H2SO4损失,导致溶液浓度偏低,正确。③少量溶液流到容量瓶外面,使溶质H2SO4损失,导致溶液浓度偏低,正确。④加水超过了刻度线,马上用胶头滴管吸去多余的水,会损失H2SO4,导致溶液浓度偏低,正确。]训练(三) 一定物质的量浓度溶液的配制1.(2021·河北邯郸五校联考)下图配制450 mL 1.00 mol·L-1 NaOH溶液的示意图,下列说法正确的是( )A.图①中应称得NaOH 18.0 gB.未进行④和⑤的操作,所配溶液浓度将偏大C.定容后把容量瓶倒置摇匀,发现液面低于刻度线不必再加水至刻度线D.步骤②后应将溶液立即转移到容量瓶中,防止药品变质C [选取500 mL 容量瓶配制NaOH溶液,称取NaOH固体的质量为0.5 L×1.00 mol/L×40 g/mol=20.0 g,A项错误;④和⑤操作是洗涤及洗涤液转移到容量瓶中,未进行上述操作,所配溶液的浓度将偏小,B项错误;定容后将容量瓶倒置摇匀,溶液粘在刻度线以上瓶颈内壁上,液面会低于刻度线,待液体回流后液面会与刻度线相平,故不必加水,C项正确;NaOH固体溶于水放出热量的热,必须冷却至室温后才能转移到容量瓶中,D项错误。]2.(2021·四川南充调研)实验需要950 mL 0.1 mol·L-1 NaCl溶液,下列有关配制过程操作正确的是( ) 实验操作A选用仪器选用950 mL容量瓶,检查是否漏液,并用蒸馏水洗净,可不烘干B称取溶质用托盘天平精确称取5.85 g NaCl,右盘放砝码,左盘加NaClC洗涤用少量蒸馏水洗涤溶解NaCl的烧杯内壁,并将洗涤液注入容量瓶D定容定容时眼睛平视刻度,用烧杯加蒸馏水至溶液凹液面与刻度线相平C [实验室没有950 mL容量瓶,应选择1 000 mL容量瓶配制NaCl溶液,A项错误;托盘天平的精确度为0.1 g,不能用托盘天平称取5.85 g NaCl,B项错误;称取的NaCl在烧杯中溶解后,转移到容量瓶中,并用少量蒸馏水洗涤烧杯内壁,将洗涤液一并注入容量瓶中,C项正确;定容时,用烧杯加蒸馏水至刻度线1~2 cm处,再用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相平,D项错误。]3.(2021·湖南常德检测)配制250 mL 0.10 mol/L的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是( )A.转移溶液后未洗涤烧杯和玻璃棒就直接定容B.称量固体氢氧化钠时速度太慢C.在容量瓶中定容时俯视刻度线D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度C [转移溶液后,未洗涤烧杯和玻璃棒就直接定容,损失溶质,则所配溶液的浓度偏小,A项错误;称量固体NaOH时,易吸收空气中水蒸气,称取NaOH的质量减小,则所得溶液的浓度偏小,B项错误;在容量瓶中定容时,俯视刻度线定容,完成后液面低于刻度线,所得溶液的浓度偏大,C项正确;定容后将容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度,待瓶颈内部的刻度线上方的液体回流后,液面会高于刻度线,所配溶液的浓度偏小,D项错误。]4.(2021·山东聊城检测)草酸钠是一种还原剂,也常作为双齿配体。室温时,甲同学配制了100 g 10%的Na2C2O4溶液,乙同学配制了100 mL 1.0 mol·L-1的Na2C2O4溶液(密度为1.02 g·cm-3)。下列说法正确的是( )A.甲同学所需溶质的质量大B.两同学所配溶液的质量相同C.两同学所需实验仪器相同D.甲同学所配溶液的浓度比乙同学的小D [甲所需溶质的质量为100 g×10%=10 g,乙所需溶质的质量为0.1 L×1.0 mol/L×134 g/mol=13.4 g,则乙同学所需溶质的质量大,A项错误;乙同学所配溶液的质量为100 mL×1.02 g/cm3=102 g,则两同学所配溶液的质量不同,B项错误;乙需要100 mL 容量瓶,而甲同学则不需要,C项错误;甲同学所需Na2C2O4的物质的量约为0.075 mol,若溶液的密度为1 g/cm3,则所配溶液的浓度约为0.075 mol/0.1 L=0.75 mol/L,故甲同学所配溶液的浓度比乙同学的小,D项正确。]5.(2021·浙江金华十校联考)实验室需配制480 mL 0.1 mol·L-1 Na2CO3溶液,下列说法不正确的是( )A.应用托盘天平称取Na2CO3·10H2O晶体14.3 gB.配制操作必需的玻璃仪器是烧杯、玻璃棒、胶头滴管、500 mL容量瓶C.采用加热来加快Na2CO3·10H2O晶体的溶解,需趁热迅速将溶液转移至容量瓶中D.定容摇匀后发现溶液液面低于刻度线,不需要再滴加蒸馏水至刻度线C [选取500 mL容量瓶配制溶液,称取Na2CO3·10H2O晶体的质量为0.5 L×0.1 mol/L×286 g/mol=14.3 g,A项正确;结合配制溶液的操作步骤可知,所需玻璃仪器是烧杯、玻璃棒、胶头滴管和500 mL容量瓶,B项正确;配制溶液时,要将溶解液冷却至室温再转移到容量瓶中,C项错误;定容摇匀后发现溶液液面低于刻度线,不需要滴加蒸馏水,待内壁沾有液体回流后,液面会与刻度线相平,D项正确。]6.(2021·福建六校联考)下图是实验室硫酸试剂标签上的部分内容,据此下列说法正确的是( )A.配制稀硫酸定容时,俯视刻度线会造成所配溶液浓度偏高B.取该硫酸1 mL与1 mL 水混合后,所得溶液的物质的量浓度为9.2 mol·L-1C.将该硫酸配成1 mol·L-1 的稀硫酸480 mL 所需玻璃仪器只有:烧杯、500 mL 容量瓶、玻璃棒D.1 mol Fe与足量的该硫酸反应产生1 mol 氢气A [配制稀硫酸时,定容俯视刻度线,所得溶液的体积偏小,则溶液的浓度偏高,A项正确;该硫酸的密度为1.84 g/cm3、质量分数为98%,则有c(H2SO4)=1 000ρw/M=(1 000×1.84×98%)/98 mol·L-1=18.4 mol·L-1,由于浓硫酸和水的密度不同,故取1 mL浓硫酸和1 mL水混合,所得溶液的浓度不是9.2 mol·L-1,B项错误;配制480 mL 1 mol·L-1 稀硫酸要选用500 mL容量瓶,缺少量取浓硫酸的量筒,C项错误;常温下,Fe在浓硫酸中发生钝化,不能产生大量H2,D项错误。]7.(2021·陕西汉中检测)实验室需要配制0.1 mol·L-1 NaOH溶液 480 mL,按下列操作步骤填上适当的文字,以使整个操作完整:(1)选择仪器及用品。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、量筒、玻璃棒、_________、____________以及等质量的两片滤纸。(2)计算。称取NaOH固体的质量为________g。(3)称量。所用砝码生锈,则所配溶液的浓度会______(填“偏高”“偏低”或“无影响”)。(4)溶解、冷却。该步实验中需要使用玻璃棒,其目的是___________________。(5)转移、洗涤。在转移时应使用_________引流,需要洗涤烧杯及玻璃棒2~3次。(6)定容、摇匀。(7)在配制过程中,某同学观察定容时液面情况如图所示,所配溶液的浓度将会________(填“偏高”“偏低”或“无影响”)。解析 (1)配制480 mL 0.1 mol·L-1 NaOH溶液,要选用500 mL容量瓶,最后定容时,距刻度线1~2 cm处,改用胶头滴管滴加蒸馏水。(2)按配制500 mL 0.1 mol·L-1 NaOH溶液计算:m(NaOH)=0.5 L×0.1 mol·L-1×40 g·mol-1=2.0 g。(3)称量时,所用砝码生锈,称得NaOH固体的质量偏大,则所配溶液的浓度偏高。(4)溶解固体溶质时,用玻璃棒进行搅拌,加速固体的溶解。(7)定容时,仰视刻度线,所配溶液的体积偏大,则所配溶液的浓度偏低。答案 (1)500 mL容量瓶 胶头滴管 (2)2.0 (3)偏高 (4)搅拌、加速溶解 (5)玻璃棒 (7)偏低
相关教案
这是一份高中化学人教版 (2019)必修 第一册实验活动1 配制一定物质的量浓度的溶液教学设计,共8页。
这是一份高中实验活动1 配制一定物质的量浓度的溶液教学设计,共8页。
这是一份高中化学第三节 物质的量教学设计及反思,共11页。