所属成套资源:2022届高考化学一轮复习教案
2022高考化学一轮复习教案:专题突破(十三) 化学实验操作的规范描述
展开
这是一份2022高考化学一轮复习教案:专题突破(十三) 化学实验操作的规范描述,共6页。
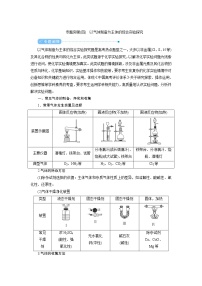
专题突破(十三) 化学实验操作的规范描述化学实验操作的规范描述是高考实验命题的重要角度,主要涉及离子(或物质)的检验、沉淀的洗涤、气密性的检验等,侧重考查化学实验基础知识和基本技能,体现《中国高考评价体系》对于“实践操作能力”的要求,涉及实验设计能力、动手操作能力、应用写作能力、语言表达能力等,能够运用口头语言和书面语言进行沟通交流,准确表达自己的看法,通过合作解决问题。1.检验离子是否已经沉淀完全的方法规范解答 将反应混合液静置,在上层清液中继续滴加沉淀剂××,若不再产生沉淀,则××离子已经沉淀完全,若产生沉淀,则××离子未完全沉淀。2.过滤时洗涤沉淀的方法规范解答 向过滤器中加蒸馏水至没过沉淀,待水自然流下后,重复操作2~3次。3.检验沉淀是否洗涤干净的方法规范解答 以FeCl3溶液与NaOH溶液制得Fe(OH)3沉淀后过滤为例:取最后一次的洗涤液少许置于试管中,加入用硝酸酸化的硝酸银溶液,若有白色沉淀生成,则沉淀未洗涤干净,若无白色沉淀生成,则沉淀已经洗涤干净。4.酸碱中和滴定判断滴定终点的方法规范解答 当滴入最后一滴××溶液时,锥形瓶中的溶液由××色变为××色,且半分钟内不再恢复原色,说明已经达到滴定终点。5.检验如图所示的装置气密性的操作方法(1)空气热胀冷缩法规范解答 关闭分液漏斗的活塞,将导管口a处用橡皮管连接一段导管放入烧杯中的水中,双手握住圆底烧瓶(或用酒精灯微热),若有气泡从导管口逸出,放开手后(或移开酒精灯后),有少量水进入导管形成一段稳定的水柱,说明装置气密性良好。(2)液面差法规范解答 将导管口a处连接一段导管并插入加水烧杯中,打开分液漏斗的活塞,从分液漏斗口注水至漏斗中的水与容器中的水形成液面差,静置观察,一段时间后若液面差保持不变,表明装置气密性良好。 若要检验整个一套连续的实验装置的气密性时,只能用空气热胀冷缩法,而且必须用酒精灯加热圆底烧瓶。6.检验某溶液中是否含有SO的操作方法规范解答 取待测液少许置于试管中,先加过量稀盐酸无明显现象(若有沉淀则静置后取上层清液继续实验);再加入氯化钡溶液,若产生白色沉淀则证明溶液里含有SO,反之则证明溶液里不含SO。7.检验某溶液中是否含有Cl-的操作方法规范解答 取待测液少许置于试管中,先加硝酸银溶液产生白色沉淀,再滴加稀硝酸,若产生的白色沉淀不溶解,则证明溶液里含有Cl-,反之则证明溶液里不含Cl-。8.检验某溶液中是否含有NH的操作方法规范解答 取待测液少许置于试管中,加入过量的浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验产生的气体,若试纸变蓝,则证明溶液里含有NH,反之则溶液里不含NH。9.检验某溶液中是否含有Fe3+的操作方法规范解答 取待测液少许置于试管中,滴入几滴硫氰化钾溶液,若溶液变红,则证明溶液里含有Fe3+,反之则证明溶液里不含Fe3+(若溶液里只含有Fe3+也可滴加氢氧化钠溶液观察沉淀的颜色)。10.检验二氧化硫气体的操作方法规范解答 将气体通入品红溶液中,若品红溶液褪色,加热褪色后的溶液红色复现,说明气体是二氧化硫。(2020·天津卷,15题节选)为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。甲方案实验原理:CuSO4+BaCl2===BaSO4↓+CuCl2实验步骤:(1)判断SO沉淀完全的操作为_________________________________________。(2)步骤②判断沉淀是否洗净所选用的试剂为________。 解析 (1)判断SO沉淀完全的操作为向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,则沉淀完全。(2)所选用的试剂为AgNO3溶液,BaSO4沉淀表面可能附着有BaCl2,为了判断沉淀是否洗净,可以向洗涤液中加入硝酸银溶液,若不产生白色沉淀,则沉淀已洗涤干净,反之则未洗涤干净。答案 (1)向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,则沉淀完全(2)AgNO3溶液(2018·全国卷Ⅲ,26题节选)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)可用作定影剂、还原剂。回答下列问题:已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaS2O3)=4.1×10-5。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液实验步骤现象①取少量样品,加入除氧蒸馏水②固体完全溶解得无色澄清溶液③__________________④________________,有刺激性气体产生⑤静置,____________⑥________________解析 Na2S2O3·5H2O晶体样品中含有SO,在SO的检验过程中应防止加入氧化剂,如H2O2,会把S2O氧化为SO,也要防止加入稀H2SO4而引入SO,所以样品加水溶解后应加入过量稀盐酸,发生反应:S2O+2H+===S↓+SO2↑+H2O。以避免生成BaS2O3沉淀,对检验产生干扰。取上层清液滴入BaCl2溶液,产生白色沉淀:Ba2++SO===BaSO4↓,证明溶液中存在SO。答案 ③加入过量稀盐酸 ④出现乳黄色浑浊 ⑤(吸)取上层清液,滴入BaCl2溶液 ⑥产生白色沉淀1.(2021·山东实验中学检测)硫酸亚铁是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:①将5%的Na2CO3溶液加入盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80 ℃之间至铁屑耗尽;③________,将滤液转入密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:(1)实验步骤①的目的是_________________________________________________。(2)写出实验步骤②中的化学方程式:___________________________________________。(3)补全实验步骤③的操作名称:_________________________________________。(4)实验步骤④中用少量冰水洗涤晶体,其目的是__________________________________________________________________________________________________________。(5)乙同学认为甲的实验方案中存在明显的不合理之处,乙同学判断的理由是________________________________________________________________________。答案 (1)去除油污(或利用碳酸钠水解呈碱性的性质除去铁屑表面油污)(2)Fe+H2SO4FeSO4+H2↑(3)趁热过滤(4)洗去杂质,降低洗涤过程中FeSO4·7H2O的损耗(5)过量硫酸使铁粉耗尽,不能防止Fe2+被氧化2.(2021·江西九江六校联考)以废旧铅蓄电池的含铅废料(主要含Pb、PbO、PbO2、PbSO4)和稀H2SO4为原料制备高纯PbO,实现铅的再生利用,其主要流程如图1:图2已知:在Fe2+催化下,Pb和PbO2反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O。(1)酸溶过程中加热的目的是_________________________________________。(2)检验滤液A中是否含有Fe2+,可选用________(填字母)。a.KSCN溶液 b.氯水 c.酸性KMnO4溶液(3)脱硫时主要反应为:PbSO4+2OH-===PbO+SO+H2O,则滤液B中的主要溶质是________________________________________________________________________。(4)冷却过滤后对所得的固体进行洗涤的操作_________________________________________________________________________________________________________。(5)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)⇌NaHPbO2(aq),其溶解度曲线如图2所示,结合上述溶解度曲线,简述由粗品PbO得到高纯PbO的操作______________________________________________________________________________________________________________________________________________________________________。解析 (3)脱硫时的化学方程式为PbSO4(s)+2NaOH===PbO(s)+Na2SO4+H2O,因而主要溶质是Na2SO4。(5)根据PbO的溶解度曲线,提纯粗PbO的方法为将粗PbO溶解在NaOH溶液中,结合溶解度曲线特点可知浓度高的NaOH溶液和较高的温度,PbO的溶解度高,因此加热至较高温度,充分溶解,然后高温下趁热过滤除去杂质,冷却后PbO又析出结晶,再次过滤可得到PbO固体。答案 (1)加快酸溶速率 (2)c (3)Na2SO4 (4)沿玻璃棒向过滤器(漏斗)中加入蒸馏水至浸没沉淀,待水慢慢流出,重复2~3次(5)将粗PbO溶解在一定量35% NaOH溶液中,加热至110 ℃,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到高纯PbO固体
相关教案
这是一份高考化学二轮复习教案专题突破(十三) 化学实验操作的规范描述(含解析),共6页。
这是一份高考化学一轮复习教案第10章第1讲 化学实验常用仪器及基本操作(含解析),共21页。
这是一份高考化学一轮复习第10章化学实验第1讲化学实验常用仪器及基本操作教案,共21页。