

所属成套资源:2022届高考统考化学人教版一轮复习教师用书(共44份)
- 2022届高考统考化学人教版一轮复习教师用书:第1部分 第8章 第2节 水的电离和溶液的酸碱性教案 教案 0 次下载
- 2022届高考统考化学人教版一轮复习教师用书:第1部分 第8章 第3节 盐类的水解 水溶液中的图像教案 教案 0 次下载
- 2022届高考统考化学人教版一轮复习教师用书:第1部分 第9章 第1节 来自化石燃料的化工原料——常见的烃教案 教案 0 次下载
- 2022届高考统考化学人教版一轮复习教师用书:第1部分 第9章 第2节 生活中常见的有机物教案 教案 0 次下载
- 2022届高考统考化学人教版一轮复习教师用书:第1部分 第10章 第1节 化学实验仪器和基本操作教案 教案 0 次下载
2022届高考统考化学人教版一轮复习教师用书:第1部分 第8章 第4节 难溶电解质的溶解平衡教案
展开
这是一份2022届高考统考化学人教版一轮复习教师用书:第1部分 第8章 第4节 难溶电解质的溶解平衡教案,共20页。
沉淀溶解平衡及应用
知识梳理
1.沉淀溶解平衡
(1)含义:在一定温度下的水溶液中,当沉淀溶解和生成的速率相等时,即建立了沉淀溶解平衡。
(2)沉淀溶解平衡的建立及特征
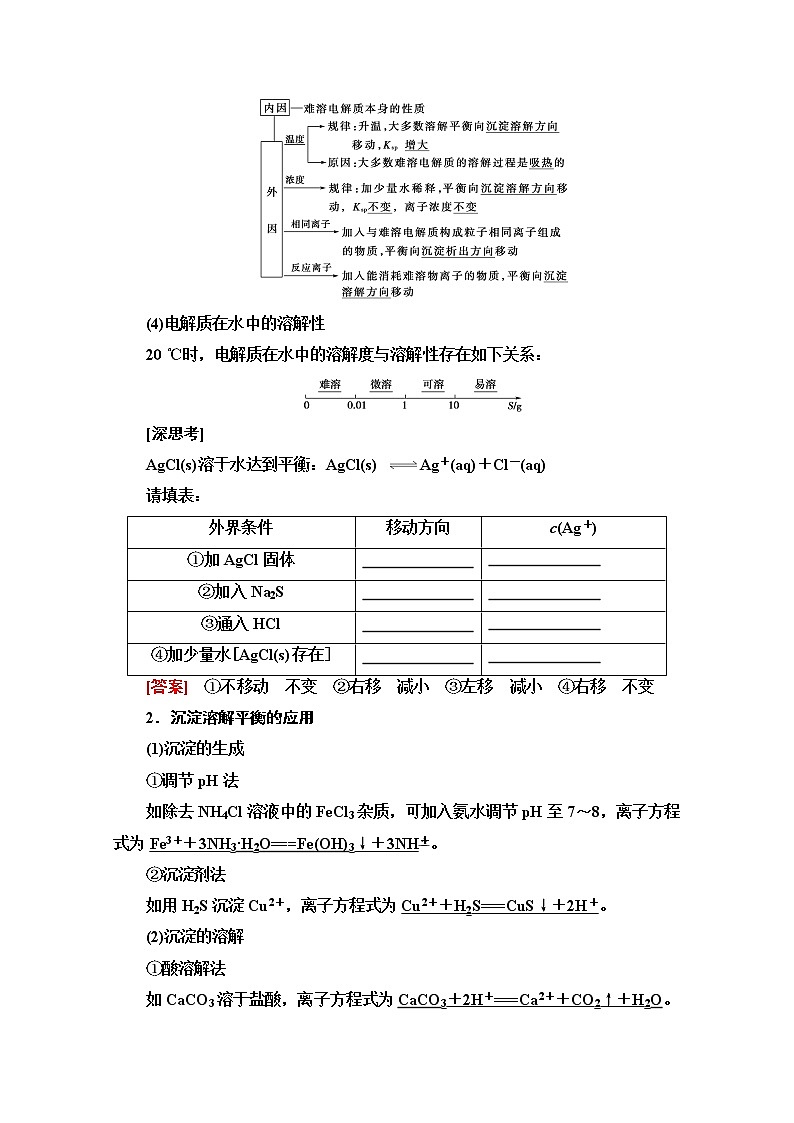
(3)沉淀溶解平衡的影响因素
(4)电解质在水中的溶解性
20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:
[深思考]
AgCl(s)溶于水达到平衡:AgCl(s) Ag+(aq)+Cl-(aq)
请填表:
[答案] ①不移动 不变 ②右移 减小 ③左移 减小 ④右移 不变
2.沉淀溶解平衡的应用
(1)沉淀的生成
①调节pH法
如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为Fe3++3NH3·H2O===Fe(OH)3↓+3NHeq \\al(+,4)。
②沉淀剂法
如用H2S沉淀Cu2+,离子方程式为Cu2++H2S===CuS↓+2H+。
(2)沉淀的溶解
①酸溶解法
如CaCO3溶于盐酸,离子方程式为CaCO3+2H+===Ca2++CO2↑+H2O。
②盐溶液溶解法
如Mg(OH)2溶于NH4Cl溶液,离子方程式为Mg(OH)2+2NHeq \\al(+,4)===Mg2++2NH3·H2O。
(3)沉淀的转化
①实质:沉淀溶解平衡的移动。
②规律:一般说来,溶解度小的沉淀容易转化成溶解度更小的沉淀。沉淀的溶解度差别越大,越容易转化。但溶解度小的沉淀在一定条件下也可以转化为溶解度大的沉淀。
③应用
a.锅炉除垢:将CaSO4转化为CaCO3,离子方程式为CaSO4(s)+COeq \\al(2-,3)(aq)===CaCO3(s)+SOeq \\al(2-,4)(aq)。
b.矿物转化:CuSO4溶液遇PbS转化为CuS,离子方程式为Cu2+(aq)+PbS(s)===CuS(s)+Pb2+(aq)。
[辨易错]
(1)Mg(OH)2溶于NH4Cl溶液的原因是NH4Cl水解生成的H+与Mg(OH)2反应。( )
(2)BaSO4(s)+COeq \\al(2-,3)(aq) BaCO3(s)+SOeq \\al(2-,4)(aq)可说明BaCO3的溶解度比BaSO4的小。( )
(3)向20 mL 0.1 ml·L-1的NaOH溶液中加10 mL 0.05 ml·L-1 MgCl2溶液,充分反应后,再加入FeCl3溶液,可发现白色沉淀变为红褐色沉淀,说明Mg(OH)2可以转化为Fe(OH)3沉淀。( )
(4)向Na2SO4溶液中加入过量的BaCl2溶液,则SOeq \\al(2-,4)沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SOeq \\al(2-,4)。( )
(5)用沉淀法除杂不可能将杂质离子全部通过沉淀除去,一般认为残留在溶液中的离子浓度小于1×10-5 ml·L-1时,沉淀已经完全。( )
[答案] (1)× (2)× (3)× (4)× (5)√
知识应用
1.下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是 。
①热纯碱溶液去油污能力强
②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用后,常用0.5%的Na2SO4溶液解毒
③溶洞、珊瑚的形成
④碳酸钡不能作“钡餐”而硫酸钡则能
⑤泡沫灭火器灭火的原理
[答案] ②③④
2.用有关离子方程式表示锅炉中水垢CaSO4的除去原理:
。
[答案] CaSO4+COeq \\al(2-,3)===CaCO3+SOeq \\al(2-,4)、
CaCO3+2H+===Ca2++CO2↑+H2O
命题点 沉淀溶解平衡及其应用
1.(2020·景德镇调研)已知Ca(OH)2的饱和溶液中存在平衡Ca(OH)2(s) Ca2+(aq)+2OH-(aq) ΔHKsp,故有沉淀生成。两种溶液混合之后,SOeq \\al(2-,4)浓度变为9×10-3 ml·L-1,根据Ksp=c(Ba2+)·c(SOeq \\al(2-,4)),计算得c(Ba2+)Ksp(AgCl),则c点表示AgCl的过饱和溶液,A项错误;b点时对应的AgCl溶液中c(Ag+)=c(Cl-),加入AgNO3晶体后,c(Ag+)>c(Cl-),不能使b点移动到a点,B项错误;由图像可知,Ksp(AgCl)=c(Ag+)·c(Cl-)=10-10,Ksp(AgBr)=c(Ag+)·c(Br-)=10-14,反应AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K=eq \f(cCl-,cBr-)=eq \f(cCl-·cAg+,cBr-·cAg+)=eq \f(KspAgCl,KspAgBr)=eq \f(10-10,10-14)=104,C项错误;a点为AgCl的饱和溶液、b点为AgBr的饱和溶液,由于饱和AgCl溶液中的c(Ag+)大于饱和AgBr溶液中的c(Ag+),二者等体积混合后,Qc(AgBr)>Ksp(AgBr),则会析出AgBr沉淀,D项正确。]
3.某温度下,分别向10.00 mL 0.1 ml·L-1的KCl和K2CrO4溶液中滴加0.1 ml·L-1 AgNO3溶液,滴加过程中-lg c(M)(M为Cl-或CrOeq \\al(2-,4))与AgNO3溶液体积(V)的变化关系如图所示。下列说法不正确的是( )
A.曲线L1表示-lg c(Cl-)与V(AgNO3)的变化关系
B.M点溶液中:c(NOeq \\al(-,3))>c(K+)>c(Ag+)>c(H+)>c(OH-)
C.该温度下,Ksp(Ag2CrO4)=4.0×10-12
D.相同实验条件下,若改为0.05 ml·L-1的KCl和K2CrO4溶液,则曲线L2中N点移到Q点
D [根据题意,K2CrO4溶液消耗的AgNO3溶液的体积多,L1表示-lg c(Cl-)与V(AgNO3)关系,L2表示-lg c(CrOeq \\al(2-,4))与V(AgNO3)的关系。将0.1 ml·L-1改为0.05 ml·L-1,消耗的AgNO3溶液体积是原来的eq \f(1,2),但-lg c(CrOeq \\al(2-,4))不变,D错误。]
[真题验收]
1.(2019·全国卷Ⅱ)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:
Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
B [A项,难溶物质的溶解度可以用物质的量浓度(摩尔浓度)表示,即图中a、b分别表示T1、T2温度下,1 L CdS饱和溶液里含a ml、b ml CdS,正确;B项,Ksp在一定温度下是一个常数,所以Ksp(m)=Ksp(n)=Ksp(p)<Ksp(q),错误;C项,向m点的溶液中加入Na2S固体,Ksp保持不变,S2-浓度增大,则Cd2+浓度减小,溶液组成由m沿mpn线向p方向移动,正确;D项,温度降低时,溶解度减小,q点的饱和溶液的组成由q沿qp线向p方向移动,正确。]
2.(2017·全国卷Ⅲ)在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
A.Ksp(CuCl)的数量级为10-7
B.除Cl-反应为Cu+Cu2++2Cl-===2CuCl
C.加入Cu越多,Cu+浓度越高,除Cl-效果越好
D.2Cu+===Cu2++Cu平衡常数很大,反应趋于完全
C [由题图可知,当-lgeq \f(cCl-,ml·L-1)=0时,lgeq \f(cCu+,ml·L-1)约为-7,即c(Cl-)=1 ml·L-1,c(Cu+)=10-7ml·L-1,则Ksp(CuCl)的数量级为10-7,A项正确;根据题目信息可知B项正确;Cu、Cu2+是按一定物质的量之比反应的,并不是加入Cu越多,Cu+浓度越高,除Cl-效果越好,C项错误;由题图可知,交点处c(Cu+)=c(Cu2+)≈10-6ml·L-1,则2Cu+===Cu2++Cu的平衡常数K=eq \f(cCu2+,c2Cu+)≈106,该平衡常数很大,因而反应趋于完全,D项正确。]
3.(2017·全国卷Ⅰ,节选)若“滤液”中c(Mg2+)=0.02 ml·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 ml·L-1,此时是否有Mg3(PO4)2沉淀生成?
(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
[解析] 根据Ksp(FePO4)=1.3×10-22及Fe3+恰好完全沉淀时溶液中c(Fe3+)=1.0×10-5 ml·L-1,可得c(POeq \\al(3-,4))=eq \f(1.3×10-22,1.0×10-5) ml·L-1=1.3×10-17 ml·L-1。c(Mg2+)=eq \f(0.02,2) ml·L-1=0.01 ml·L-1,则c3(Mg2+)·c2(POeq \\al(3-,4))=0.013×(1.3×10-17)2=1.69×10-40≈1.7×10-40
相关教案
这是一份2022届高考统考化学人教版一轮复习教师用书:第1部分 第7章 第1节 化学反应速率教案,共26页。
这是一份2022届高考统考化学人教版一轮复习教师用书:第1部分 第6章 第2节 原电池 化学电源教案,共24页。
这是一份2022届高考统考化学人教版一轮复习教师用书:第1部分 第6章 第1节 化学能与热能教案,共28页。








