



沪教版九年级下册第7章 应用广泛的酸、碱、盐第3节 几种重要的盐优质ppt课件
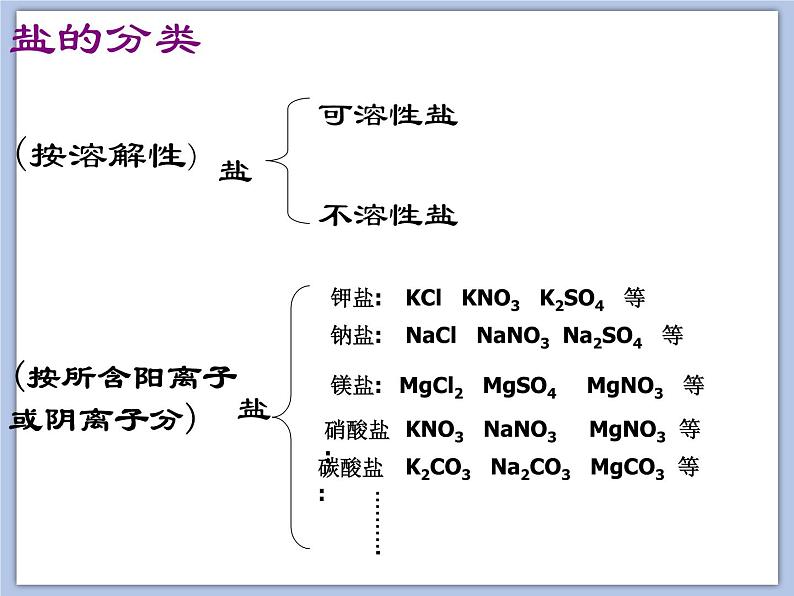
展开(按所含阳离子或阴离子分)
KCl KNO3 K2SO4 等
NaCl NaNO3 Na2SO4 等
MgCl2 MgSO4 MgNO3 等
KNO3 NaNO3 MgNO3 等
K2CO3 Na2CO3 MgCO3 等
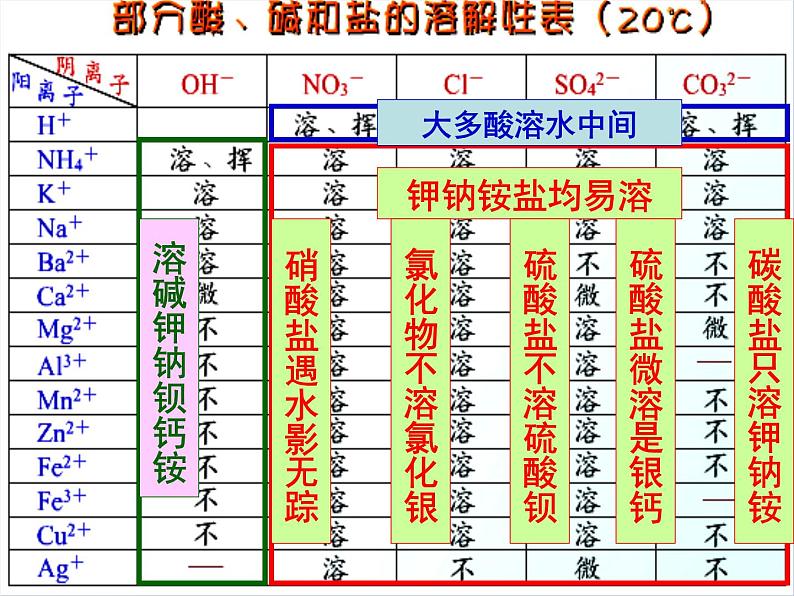
可溶性盐:钾盐(含K+)、钠盐(含Na+)
大部分碳酸盐如CaCO3、BaCO3、MgCO3等
铵盐(含NH4+)、硝酸盐(含NO3-)
硫酸钡BaSO4、 氯化银AgCI
如Fe(OH)3、Cu(OH)2、Mg(OH)2等
KOH 、NaOH 、Ba(OH)2Ca(OH)2 、NH3.H2O
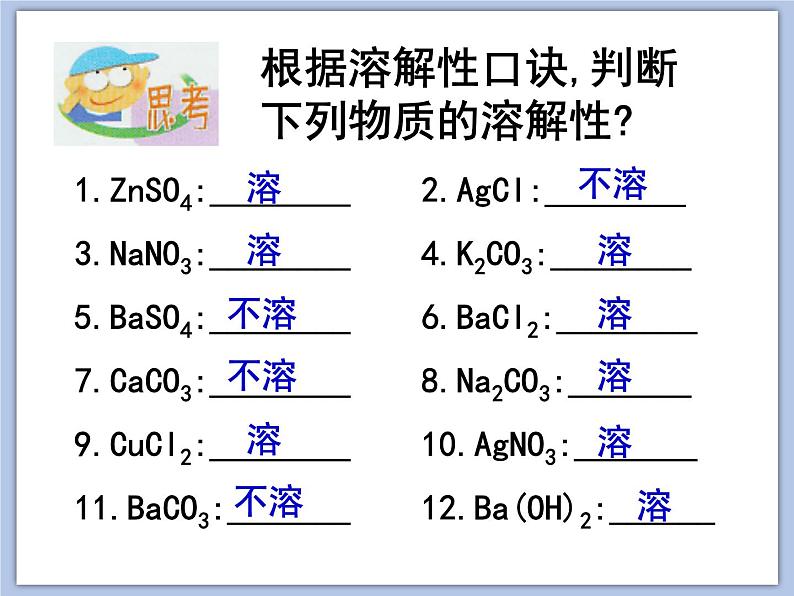
根据溶解性口诀,判断下列物质的溶解性?
1.ZnSO4: 2.AgCl:________3.NaNO3:________ 4.K2CO3:________5.BaSO4:________ 6.BaCl2:________7.CaCO3:________ 8.Na2CO3:_______9.CuCl2:________ 10.AgNO3:_______11.BaCO3:_______ 12.Ba(OH)2:______
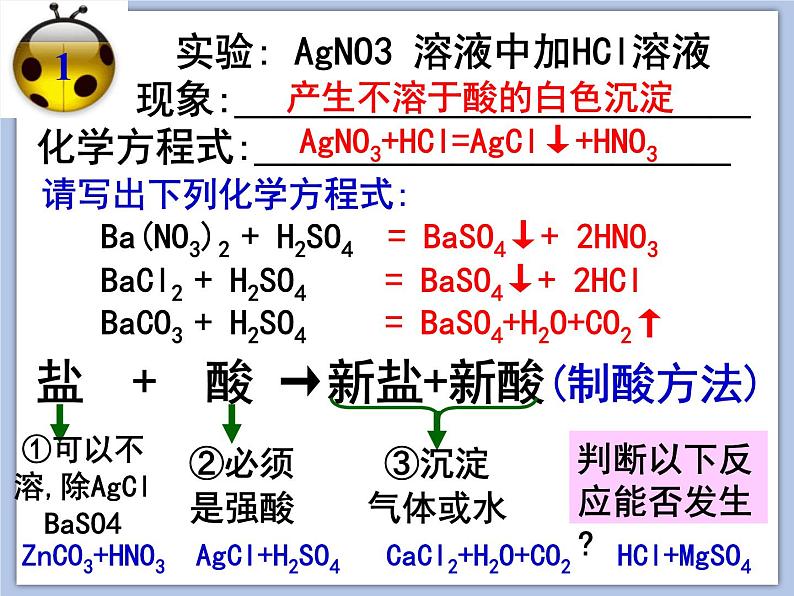
盐 + 酸 →新盐+新酸(制酸方法)
实验: AgNO3 溶液中加HCl溶液 现象:_____________化学方程式:____________
产生不溶于酸的白色沉淀
AgNO3+HCl=AgCl↓+HNO3
= BaSO4↓+ 2HNO3
= BaSO4+H2O+CO2↑
请写出下列化学方程式:
= BaSO4↓+ 2HCl
①可以不溶,除AgClBaSO4
判断以下反应能否发生?
ZnCO3+HNO3 AgCl+H2SO4 CaCl2+H2O+CO2 HCl+MgSO4
实验: FeCl3溶液中加NaOH溶液, 现象:___________化学方程式:____________
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
盐+碱→新盐+新碱(制碱的方法)
Ba(OH)2+Mg(NO3)2Na2CO3 + Ca(OH)2 CuCl2 + 2KOH
= 2KCl + Cu(OH)2↓
= CaCO3↓ + 2NaOH
= Ba(NO3)2+Mg(OH)2↓
判断以下反应能否发生:
Ca(OH)2+CuCO3 Na2SO4+KOH Mg(OH)2+FeCl3 K2CO3+Ba(OH)2
Ba(NO3)2+ZnSO4=Ba(NO3)2+Na2CO3=BaCl2+Na2CO3 =BaCl2+ZnSO4 =BaCl2+2AgNO3 =Na2CO3+2AgNO3=
CaCO3+FeCl3
Zn(NO3)2+BaSO4↓
2NaNO3+BaCO3↓
2NaCl+BaCO3↓
ZnCl2+BaSO4↓
Ba(NO3)2+2AgCl↓
2NaNO3+Ag2CO3↓
盐 + 盐→ 新盐 + 新盐
CuSO4+Mg(NO3)2 BaCO3+NaSO4NH4Cl+Na2CO3 AgCl+Fe(NO3)2
(1).[实验]在盛有Na2CO3溶液的试管里加入CaCl2溶液,可发现:________
Na2CO3+CaCl2 = CaCO3↓ +2NaCl
Na2CO3溶液和CaCl2溶液反应生成两种新的盐: CaCO3和NaCl。这个反应的原理是怎样的?
盐 + 盐 = 新盐 + 新盐
碳酸钠与氯化钙反应原理分析:
Na2CO3溶液中含有离子
CaCl2溶液中含有离子
Na2CO3+CaCl2 = CaCO3↓+ 2NaCl
2Na++CO32-+Ca2++2Cl-==CaCO3↓+2Na++2Cl-
你能找出这个反应类型有什么特点?
这种反应类型的特点是:两种化合物互相交换成分生成新的化合物。
(2) 定义:由于化合物互相交换成分生成新化合物的反应叫复分解反应。
这种反应类型叫复分解反应。
为什么KNO3和NaCl不发生复分解反应?
KNO3溶液中含有离子
NaCl溶液中含有离子
K+ + NO3- + Na+ + Cl- = Na++ NO3- + K+ + Cl-
(3)复分解反应的条件:
生成物中有沉淀或气体或水。
2NaOH + H2SO4 = Na2SO4 + 2H2O
Na2CO3+Ca(OH)2 = CaCO3↓ +2NaOH
2HCl + CaCO3 = CaCl2 + H2O + CO2↑
下列4个反应是复分解反应吗?看看它们的生成物有什么规律?
NaOH+BaCl2= Ba(OH)2+NaCl
复分解反应及发生条件 AB + CD = AD + CB
(1)发生范围:酸.碱.盐.金属氧化物四大类物质之间
(2)反应进行的环境:大多数在水溶液中进行
复分解反应口诀:复分解,两头顾;先顾头,后顾尾;顾头要看溶解性,盐碱盐盐均可溶;可以反应再顾尾,产生气体沉淀水;交换离子写反应,气体沉淀标符号。
下列物质能发生化学反应吗?为什么?
1、CuO+Ba(OH)2= Cu(OH)2 ↓ +BaO 2、SO2+HNO3=NO2 + H2SO33、2Fe(OH)3+3MgCl2=2FeCl3+3Mg (OH)2 ↓4、Na2CO3+CaCl2 = CaCO3 ↓ +2NaCl
因为---1:碱不能与金属氧化物反应。2:酸不能与非金属氧化物反应。3:Fe(OH)3难溶
5、Na2CO3+2HCl= 2Na Cl +H2O+ CO2↑6、 Ba(OH)2+H2SO4= BaSO4 ↓ +2H2O7、NaOH+BaCl2= Ba(OH)2+NaCl8、2NaCl+Cu(NO 3) 2= 2Na NO3+CuCl2
因为---7和8:不符合复分解反应的条件。
两种化合物相互交换成分,生成另外两种化合物的化学反应
一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应
AB + CD = AD + CB
A + BC = B + AC
1、Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑
3、BaCl2 + H2SO4 = BaSO4↓ + 2HCl
4、Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓
6、NaOH + HCl = NaCl + H2O
5、CaO + H2O =Ca(OH)2
2、Zn + H2SO4 = ZnSO4 + H2↑
7、 CaCO3 高温 CaO + CO2 ↑
判断下列反应分别属于哪种基本反应类型?
下列方程式属中和反应的有______;属复分解的有_________;属置换反应的有________.
1、BaCl2 + H2SO4 = BaSO4 ↓ + 2HCl 2、Fe2O3 + 3 H2SO4 = Fe2(SO4)3 +3 H2O 3、Fe + H2SO4 == FeSO4 + H2 ↑ 4、Na2CO3 + H2SO4 =Na2SO4 + CO2 ↑+ H2O 5、Ca(OH)2 + H2SO4 == CaSO4 + 2H2O 6、Na2CO3+ Ca(OH)2= CaCO3↓+H2O 7、BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2 8、(NH4)2SO4+Ca(OH)2==CaSO4+2NH3 ↑ +H2O
中和反应是否是复分解反应?
(4)酸碱盐之间的反应一般是复分解反应。
复分解反应不一定是中和反应,而中和反应一定是复分解反应,即中和反应是复分解反应中的一种。
根据酸的共性和碱的共性,以及盐的有关性质,你知道可以用哪些方法制取盐?
(1)有些盐是天然存在的。如:食盐、纯碱等,但有些是用化学方法制取。
1、酸+金属=盐+氢气
7、盐+盐=新盐+新盐
8、金属+盐=新金属+新盐(下节学习)
6、碱+酸性氧化物=盐+水
5、碱+盐=新碱+新盐
4、酸+盐=新酸+新盐
2、酸+金属氧化物=盐+水
下列各组溶液中,不用其他试剂,只用组内溶液互相混合的方法就能鉴别的一组是 ( )
A. Na2SO4、BaCl2、KNO3、NaCl
B. CuSO4、H2SO4、BaCl2、HCl
C. NaOH、Na2SO4、FeCl3、BaCl2
D. NaCl、AgNO3、NaNO3、HCl
【做一做】现有A、B、C、D、E五瓶无色溶液,它们是盐酸、氯化钠、氯化钙、氢氧化钙和碳酸钠。为了确定它们各是哪一种,进行一系列实验,其中观察到如下现象:
(1) B跟C两溶液混合,产生白色沉淀;
(2) B跟D两溶液混合,产生白色沉淀;
(3) B跟E两溶液混合,产生气泡;
(4) C溶液能使红色石蕊试纸变蓝。
分析上述实验现象,推断出A、B、C、D、E的化学式:
A ______ B ________ C ________ D ______ E ____
B+C的化学反应方程式:
Na2CO3+ Ca(OH)2=CaCO3↓+2NaOH
1.从理论上判断复分解反应能否发生,一般不考虑的因素是( )A.反应物的溶解性B.生成物中有无气体.沉淀和水C.反应物中有无酸碱盐D.金属活动性强弱
2.思考:硝酸钾.硝酸钠为何一般不参加复分解反应?
3.下列各组在溶液中能大量共存的是( )A.KOH CuSO4 NaCl B.NaCl Na2CO3 Ba(OH)2C.Ca(0H)2 KCl H2SO4 D.Na2CO3 KOH NaCl
难以形成沉淀.气体或水
4.已知某无色溶液中含有硫酸,则该溶液中还可能含有的物质是( ) A.硫酸铜 B.氧化钙 C.硫酸锌 D.氢氧化钠
5.下列各组物质的溶液,不能发生复分解反应是( )A.HCl和Ca(OH)2 B.Na2CO3和H2SO4 C.AgNO3和BaCl2 D.KCl和CuSO4
6.白色粉末,可能含中的一种或几种,将粉末溶于水为无色溶液,当加入BaCl2溶液后有白色沉淀产生,再加入过量盐酸,白色沉淀溶解,有气泡放出。原混合物中一定含有______,一定不含有_______。
BaSO4不溶于水,也不与酸反应式
BaCO3+2HCl==BaCl2+H2O+CO2↑
BaCl2 + MgSO4 ==== BaSO4↓ + MgCl2
8.有一包固体粉末,可能由中的一种或几种组成,做实验得以下结果:(1)将此固体粉末加到水中,得到白色沉淀,上层清液为无色. (2)该白色沉淀不溶于稀硝酸.从实验可判断出,该粉末中一定含有______,一定不含有______。
9.用化学方法区别五瓶无色液体?
Na2SO4BaCl2
CaCO3.CuSO4
10.在一条鱼虾绝迹的小河边,有四座工厂:甲.乙.丙.丁,他们排放的废液里,每厂只有碳酸钠.氯化铁.氢氧化钙.盐酸的一种,某中学环保小组对实现调查的情况如图,甲处的河水是乳白色的,乙处的河水是红褐色的,丙处的河水变清了,丁处的河水是清的,但有气泡产生,请推测这四座工厂废液里的污染物.
初中化学沪教版九年级下册第3节 几种重要的盐习题ppt课件: 这是一份初中化学沪教版九年级下册第3节 几种重要的盐习题ppt课件,共24页。PPT课件主要包含了氯化钠,小苏打,碳酸钙,建筑材料,补钙剂,CaCO3,NaCl,Na2CO3,NaHCO3,大量气泡等内容,欢迎下载使用。
九年级下册第3节 几种重要的盐复习课件ppt: 这是一份九年级下册第3节 几种重要的盐复习课件ppt,共23页。PPT课件主要包含了知识网络,几种重要的盐,几种常见的盐,化学肥料,定义分类氮肥,知识点1盐,知识回顾,阳离子,有沉淀生成,有气体放出等内容,欢迎下载使用。
初中化学沪教版九年级下册第3节 几种重要的盐复习ppt课件: 这是一份初中化学沪教版九年级下册第3节 几种重要的盐复习ppt课件,共18页。PPT课件主要包含了盐酸与氢氧化钠反应,硫酸与氢氧化钠反应,中和反应的实质,中考题等内容,欢迎下载使用。













