




高考化学总复习专题十一弱电解质的电离和溶液的酸碱性完美课件PPT
展开
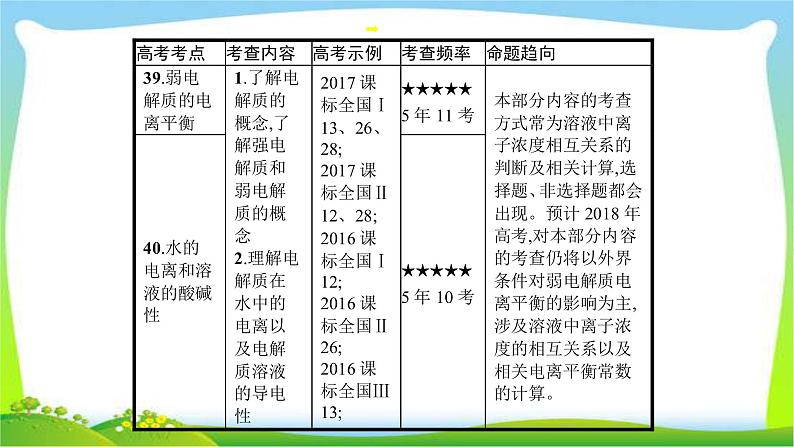
这是一份高考化学总复习专题十一弱电解质的电离和溶液的酸碱性完美课件PPT,共60页。PPT课件主要包含了考点39,考点40,考点41,试做真题,高手必备,萃取高招,对点精练,电离平衡常数,水的电离等内容,欢迎下载使用。
本专题内容是历年高考的必考点,常以选择题和非选择题的形式呈现,主要涉及弱电解质的判断、电离平衡的影响因素、由水电离的c(H+)或c(OH-)的求算、相关弱电解质电离常数的计算、溶液酸碱性的判断、pH的简单计算等。
复习本专题时要注意:(1)理解电解质与非电解质、强电解质和弱电解质的概念,理解电解质强弱与其溶解性、溶液导电性强弱的关系;(2)理解水是一种常见的弱电解质,理解水的电离受温度、酸、碱、活泼金属等物质的影响;(3)弱电解质的电离平衡是化学平衡的一种,化学平衡移动原理仍然适用,要善于运用化学平衡移动原理分析电离平衡的相关问题;(4)理解水的离子积的含义、适用范围等,能利用水的离子积规范解题并进行简单计算。
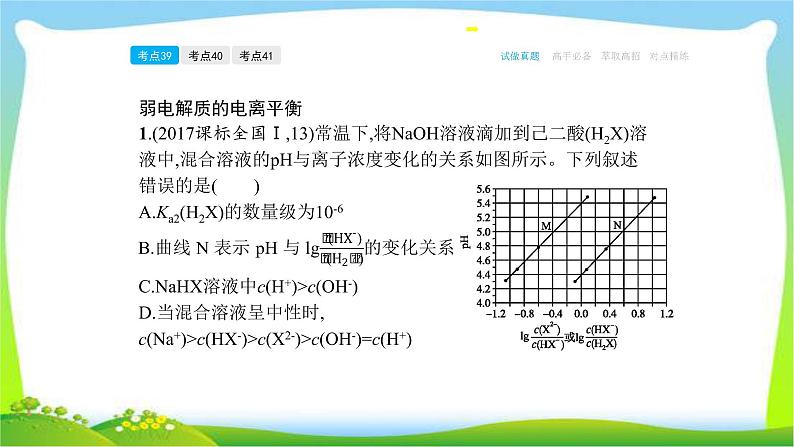
弱电解质的电离平衡1.(2017课标全国Ⅰ,13)常温下,将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )A.Ka2(H2X)的数量级为10-6
C.NaHX溶液中c(H+)>c(OH-)D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
【答案】 D 在横坐标为0.0时,由曲线M对应的pH大于曲线N对应
上横、纵坐标清晰的一点代入可得Ka2的数量级为10-6,A项正确;由曲线M、N上横坐标为0.0的点对应的pH均小于7,可知HX-的电离程度大于其水解程度,则C项正确;由图像可知,当pH等于7
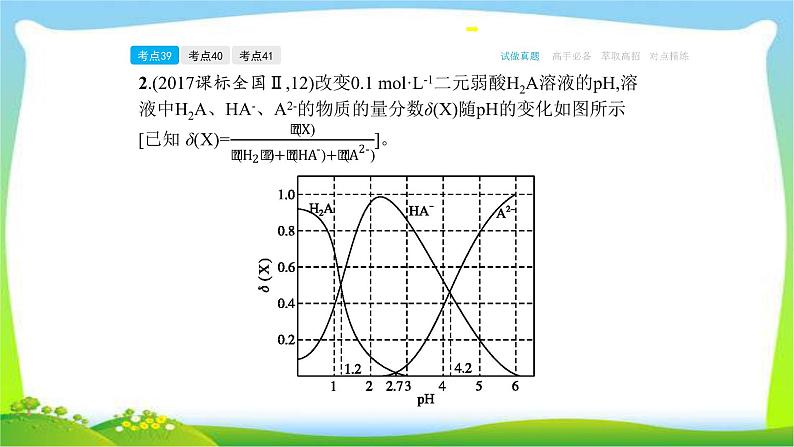
2.(2017课标全国Ⅱ,12)改变0.1 ml·L-1二元弱酸H2A溶液的pH,溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示
下列叙述错误的是( )A.pH=1.2时,c(H2A)=c(HA-)B.lg[K2(H2A)]=-时,c(HA-)>c(H2A)=c(A2-)D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
【答案】 D A项,根据图像,pH=1.2时,H2A和HA-物质的量分数相同,则有c(H2A)=c(HA-),A正确;B项,根据pH=4.2点,K2(H2A)=
量分数最大,H2A和A2-物质的量分数相同,则有c(HA-)>c(H2A)=c(A2-),C正确;D项,根据pH=4.2时,c(HA-)=c(A2-),且物质的量分数约为0.48,而c(H+)=10-4.2 ml·L-1,可知c(HA-)=c(A2-)>c(H+),D错误。
3.(2015课标全国Ⅰ,13)浓度均为0.10 ml·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg 的变化如图所示。下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性B.ROH的电离程度:b点大于a点C.若两溶液无限稀释,则它们的c(OH-)相等
【答案】 D 由题中信息知,0.1 ml·L-1的MOH溶液pH=13,MOH为强碱,0.1 ml·L-1的ROH溶液11HF>CH3COOH>H2CO3>H2S>HClO。
(3)特点:电离平衡常数只与温度有关,与电解质的浓度无关。由于电离过程是吸热的,故温度升高,K 增大;多元弱酸是分步电离的,各级电离常数的大小关系是K1≫K2……,所以其酸性主要决定于第一步电离。(4)影响因素①内因:物质的结构。②外因:温度。同一弱电解质,温度一定,K一定;升高温度,K值增大,原因是电离是吸热过程,升高温度弱电解质电离程度增大。
(5)有关电离平衡常数的计算(以弱酸HX为例)①已知c0(HX)和c(H+),求电离平衡常数
起始:c0(HX) 0 0平衡:c0(HX)-c(H+)c(H+)c(H+)
由于弱酸只有极少一部分电离,c(H+)的数值很小,可近似认为:c0(HX)-c(H+)≈c0(HX),则K= ,代入数值求解即可。
【疑难辨析】 (1)强电解质的溶液不一定比弱电解质的溶液导电性强。因电解质溶液的导电性强弱取决于溶液中离子浓度大小及离子所带电荷的多少。(2)硫酸钡虽难溶于水,但因其溶于水的部分完全电离,属于强电解质。电解质的强弱与电解质的溶解性无关。(3)在一定温度下,稀释弱酸或弱碱溶液时,溶液中并不是所有粒子浓度都会减小。对于弱酸或弱碱溶液,只要对其稀释,电离平衡均会正向移动。例如HA溶液稀释时,c(HA)、c(H+)、c(A-)均减小(参与平衡建立的微粒);由于温度不变,KW不变,故c(OH-)会增大。(4)改变条件,若使弱电解质电离平衡正向移动,电离平衡常数不一定增大。电离常数只与温度有关。
典例导引能证明乙酸是弱酸的实验事实是( )A.CH3COOH溶液与Zn反应放出H2B.0.1 ml·L-1 CH3COONa溶液的pH大于7C.CH3COOH溶液与Na2CO3反应生成CO2D.0.1 ml·L-1 CH3COOH溶液可使紫色石蕊溶液变红【解析】 强酸与弱酸均能与Zn反应放出H2,A项错误;0.1 ml·L-1 CH3COONa溶液的pH大于7,证明CH3COONa是一种强碱弱酸盐,能证明CH3COOH是弱酸,B项正确;CH3COOH溶液与Na2CO3反应生成CO2,证明CH3COOH酸性强于H2CO3,但不能证明CH3COOH是弱酸,C项错误;强酸与绝大多数弱酸溶液均可使紫色石蕊溶液变红,D项错误。【答案】 B
高招1证明弱电解质的实验方法要证明某电解质是弱电解质,关键在于一个“弱”字,即证明它只是部分电离或其溶液中存在电离平衡。以一元弱酸HA为例,证明它是弱电解质的常用方法有:
典例导引在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是 (用字母表示,下同)。 (2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是 。 (3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是 。 (4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 。 (5)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 ,反应所需时间的长短关系是 。 (6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是 。
【解析】 解答本题要注意以下三点:①盐酸、硫酸都是强酸,但H2SO4是二元强酸。②CH3COOH是弱酸,在水溶液中不能完全电离。
【答案】 (1)b>a>c (2)b>a=c (3)c>a>b(或c>a=2b) (4)c>a=b (5)a=b=c a=b>c (6)c>a=b
高招2多角度比较一元弱酸与一元强酸(1)一元强酸与一元弱酸的比较
(2)稀释时pH变化特点比较①相同体积、相同浓度的盐酸、醋酸
一般来说,加水稀释相同的倍数,醋酸的pH变化小;加水稀释到相同的pH,盐酸加入的水多。
②相同体积、相同pH的盐酸、醋酸加水稀释相同的倍数,盐酸的pH变化大;加水稀释到相同的pH,醋酸加入的水多。(3)一元弱碱与一元强碱的比较规律及稀释时pH变化与以上类似。
1.pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积的关系如图所示,下列说法不正确的是( )①若aH2S>HCN>HS-,因此这些离子能够大量共存,B正确;根据物料守恒,c(Na+)=c(S2-)+c(HS-)+c(H2S),C正确;根据电离平衡常数,HCOOH的酸性强于HCN,两种溶液等pH等体积时,c(HCN)>c(HCOOH),HCOOH溶液消耗NaOH溶液的体积小于HCN溶液,D正确。
水的电离和溶液的酸碱性1.(经典考题)已知温度T时水的离子积常数为KW,该温度下,将浓度为a ml·L-1的一元酸HA与b ml·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )A.a=bB.混合溶液的pH=7
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
【答案】 C A项,a=b只能说明酸碱恰好完全反应生成盐和水,由于HA和BOH的酸碱性强弱未知,故溶液不一定呈中性,A项错误;B项,未指明条件是25 ℃,所以pH=7并不能说明溶液呈中性,B项错误;C项,由于混合溶液中c(H+)= ml·L-1,结合KW=c(H+)·c(OH-),可推断出c(H+)=c(OH-),所以溶液一定呈中性,C项正确;D项是电荷守恒表达式,无论溶液是否呈中性都满足此式,D项错误。
2.(2015广东卷,11)一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )A.升高温度,可能引起由c向b的变化B.该温度下,水的离子积常数为1.0×10-13C.该温度下,加入FeCl3可能引起由b向a的变化D.该温度下,稀释溶液可能引起由c向d的变化
【答案】 C c点、b点对应的温度相同,A项错误;根据b点对应的纵坐标和横坐标都为1.0×10-7 ml·L-1可知,水的离子积常数为1.0×10-14,B项错误;FeCl3为强酸弱碱盐,水解使溶液呈酸性,C项正确;c、d点对应的c(H+)相同,c(OH-)不同,但由于KW只与温度有关,所以温度不变时,稀释溶液不可能引起由c向d的变化,D项错误。
25 ℃时,纯水中c(H+)=c(OH-)=1×10-7 ml·L-1。任何水溶液中,由水电离出来的c(H+)与c(OH-)都相等。 2.水的离子积常数(1)水的离子积常数:KW=c(H+)·c(OH-)。25 ℃时,KW=1×10-14;100 ℃时,KW=1×10-12。(2)影响因素:只与温度有关,升高温度,KW增大。(3)适用范围:KW不仅适用于纯水,也适用于酸、碱、盐的稀溶液。(4)KW揭示了在任何水溶液中均存在H+和OH-,只要温度不变,KW就不变。
3.影响水电离平衡的因素(1)温度:升高温度,水的电离程度增大;降低温度,水的电离程度减小。(2)酸或碱均能抑制水的电离。(3)能水解的盐促进水的电离。
【疑难辨析】 (1)水的离子积常数KW=c(H+)·c(OH-)中,H+和OH-不一定都是水电离出来的。(2)NaCl溶液和CH3COONH4溶液均显中性,但两溶液中水的电离程度不相同。醋酸铵水解促进水的电离,而NaCl对水的电离无影响。
4.pH定义pH=-lgc(H+)。pH的适用范围为0~14。超过这一范围,一般不用pH表示溶液的酸碱性。5.25 ℃时溶液酸碱性与pH的关系
6.pH的测定(1)pH试纸法:粗略测定溶液的pH。广泛pH试纸一般可测出溶液pH的整数值。使用方法:①检验溶液的酸碱性:取一小块试纸在表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测液点于试纸的中部,将变化后的颜色与标准比色卡对比,确定溶液的酸碱度。测溶液pH的试纸不能事先用蒸馏水润湿。②检验气体的酸碱性:先用蒸馏水把试纸润湿,粘在玻璃棒的一端,再置于盛有待测气体的容器口附近,观察试纸颜色的变化,判断气体的性质。(试纸不能触及器壁)(2)pH计:用来精确测定溶液pH。
【疑难辨析】 (1)在测量某溶液的pH时,pH试纸不能用蒸馏水润湿,否则待测液因被稀释可能产生误差。中性溶液的pH不变,非中性溶液的pH测定值将比实际值偏大(酸性溶液)或偏小(碱性溶液);(2)广泛pH试纸读出的pH只能是整数;(3)不能用pH试纸测定氯水的pH,因为氯水呈现强氧化性(漂白性),能使试纸褪色。
典例导引(2017四川新津模拟)现有室温条件下的四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有关说法正确的是( )A.由水电离出的c(H+):①=②=③=④B.将②③溶液混合后,pH=7,消耗溶液的体积:③=②C.等体积的①②④溶液分别与足量铝粉反应,②生成的H2的物质的量最大D.分别向等体积四种溶液中加入100 mL水后,溶液的pH:③>④>①>②
【解析】 A项,①②的氢离子浓度相同且等于③④中的氢氧根离子浓度,相同条件下,水的离子积常数是定值,无论酸还是碱都抑制水的电离,所以这四种溶液中由水电离的c(H+):①=②=③=④,A正确;B项,NH3·H2O是弱碱只有少部分电离,所以c(NH3·H2O)>c(OH-),氯化氢是强电解质,所以其溶液中c(HCl)=c(H+),即c(NH3·H2O)>c(HCl),若将氨水和盐酸混合后溶液呈中性,则消耗溶液的体积:②>③,B错误;C项,醋酸是弱酸,氯化氢和氢氧化钠是强电解质,①②④三种溶液的物质的量浓度关系为①>②=④,所以等体积的①②④溶液分别与铝粉反应,生成H2的量:①最大,②最小,C错误;D项,醋酸是弱酸,加水稀释能促进醋酸的电离,所以①②稀释后溶液的pH:7>②>①;NH3·H2O是弱碱,加水稀释能促进NH3·H2O的电离,所以③④稀释后溶液的pH:③>④>7,故向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>①,D错误。【答案】 A
高招1求解溶液中由水电离出的c(H+)或c(OH-)的方法(25 ℃时)(1)中性溶液:c(H+)=c(OH-)=1.0×10-7 ml·L-1。(2)溶质为酸的溶液H+来源于酸电离和水电离,而OH-只来源于水。若计算pH=2的盐酸中水电离出的c(H+),方法是先求出溶液中的c(OH-)=1×10-12 ml·L-1,即水电离出的c(H+)=c(OH-)=1×10-12 ml·L-1。(3)溶质为碱的溶液OH-来源于碱电离和水电离,而H+只来源于水。如pH=12的NaOH溶液中,c(H+)=1×10-12 ml·L-1,即水电离产生的c(OH-)=c(H+)=1×10-12 ml·L-1。
(4)能水解的盐溶液H+和OH-均由水电离产生。如pH=4的NH4Cl溶液中,由水电离出的c(H+)=1×10-4 ml·L-1;pH=11的Na2CO3溶液中,由水电离出的c(OH-)=1×10-3 ml·L-1。因此,当溶液中由水电离出的c(H+)7
高招2计算溶液pH的多种方法(25 ℃)(1)强酸溶液:如浓度为c ml·L-1的HnA溶液,c(H+)=nc ml·L-1,所以pH=-lg(nc)。(2)强碱溶液:如浓度为c ml·L-1的B(OH)n溶液,c(OH-)=nc ml·L-1,
(3)溶液混合后pH的计算:计算出溶液中的c(H+)后,再根据公式求pH。
(4)酸碱稀释时pH的变化
①强酸与强碱溶液无限稀释时,酸或碱的pH只能接近7,酸的pH不大于7,碱的pH不小于7。巧记口诀:“酸是酸,碱是碱,无限稀释7为限。”②pH相同的强酸和弱酸(或强碱和弱碱)溶液稀释相同的倍数,强酸(或强碱)溶液的pH变化幅度大。巧记口诀:“起点倍数都一样,总是强者变化急。”
(5)酸碱等体积混合后溶液酸碱性的判断将强酸、强碱溶液以某体积之比混合,若混合液呈中性,则c(H+)∶c(OH-)、V碱∶V酸、pH酸+pH碱之间的关系有如下规律:因
1.(2013大纲全国,12)下图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )A.两条曲线间任意点均有c(H+)·c(OH-)=KWB.M区域内任意点均有c(H+)c(OH-)C.在B点,两者恰好完全反应D.在C点,c(X-)+c(HX)=0.1 ml·L-1
【答案】 B 根据图像可知,0.100 0 ml·L-1 HX溶液的2c(Na+)>c(H+)>c(OH-),B项正确;在B点,pH=7,加入的NaOH溶液体积小于25.00 mL,没有恰好完全反应,C项错误;在C点,溶液的总体积为50 mL,由物料守恒可知:c(X-)+c(HX)=
相关课件
这是一份课标III卷B版高考二轮总复习化学专题十一电化学完美课件PPT,共60页。
这是一份高考化学总复习专题十五化学实验基础完美课件PPT,共60页。PPT课件主要包含了考点50,考点51,试做真题,高手必备,萃取高招,对点精练,2常用计量仪器,4其他仪器,②防堵塞安全装置等内容,欢迎下载使用。
这是一份高考化学总复习专题十化学反应速率和化学平衡完美课件PPT,共60页。PPT课件主要包含了考点35,考点36,考点37,考点38,试做真题,高手必备,萃取高招,对点精练,化学反应速率,透析真题等内容,欢迎下载使用。








