




高中化学人教版 (新课标)必修1第一节 物质的分类授课课件ppt
展开
这是一份高中化学人教版 (新课标)必修1第一节 物质的分类授课课件ppt,共51页。PPT课件主要包含了质地柔软,银白色有金属光泽,小于100℃,第三周期ⅠA族,还原性,熔游响红,钠与盐溶液反应模型,盐溶液,Na先与H2O反应,H2O减少等内容,欢迎下载使用。
ρ(H2O)___ρ(Na)___ρ(煤油)
> >
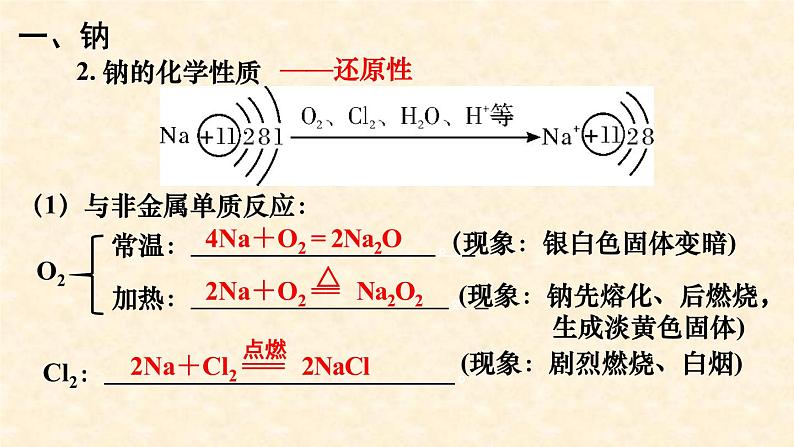
(1)与非金属单质反应:
(现象:钠先熔化、后燃烧, 生成淡黄色固体)
(现象:银白色固体变暗)
(现象:剧烈燃烧、白烟)
Cl2: 。
4Na+O2 = 2Na2O
(2)与水、醇、酸、盐反应:
2Na+2H2O = 2NaOH + H2↑
① 与水(滴加酚酞)反应:
化学方程式: 。
实验现象: 。
化学方程式: 。
2Na+2CH3CH2OH → 2CH3CH2ONa +H2↑
钠与水反应比钠与乙醇反应______(填“快”或“慢”)。
2Na+2H2O + CuSO4 = Na2SO4+H2↑ +Cu(OH)2↓
2Na+2HCl = 2NaCl + H2↑
化学方程式: 。
如Na投入CuSO4溶液的化学方程式: 。
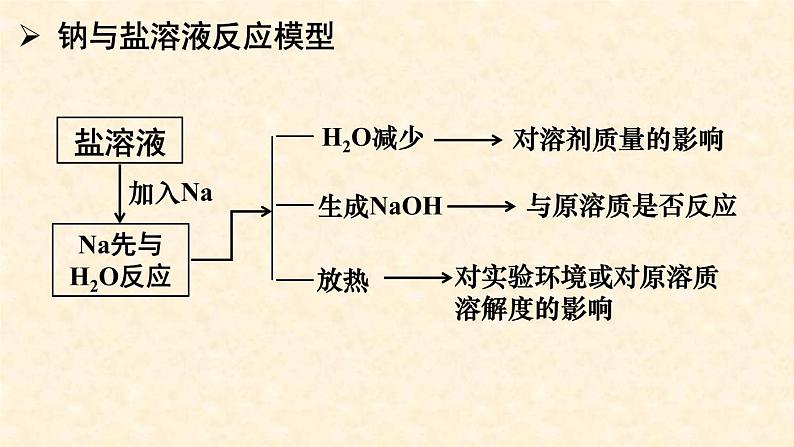
将Na投入到饱和Ca(OH)2溶液中,有什么现象?从加入Na到恢复室温, Ca(OH)2溶液的浓度、溶解度、溶液中Ca2+数目如何变化?
钠浮在水面上,熔成一个闪亮的小球,小球四处游动,溶液中有白色固体析出。
Ca(OH)2溶液的浓度、溶解度先下降再升高恢复至原值, Ca2+数目先减少后增加,但最终数目比原溶液少。
1. 常温下,将金属钠投放入盛有下列溶液的小烧杯中,既有气体产生,又有白色沉淀生成的是__________(填序号)。 ①MgSO4溶液 ②Na2SO4稀溶液 ③饱和澄清石灰水 ④Ca(HCO3)2溶液 ⑤CuSO4溶液 ⑥饱和NaCl溶液
①将Na投入到Ca(HCO3)2溶液中,反应后生成正盐溶液:___________________________________________________。② 将Na投入到NH4HCO3溶液中,有刺激性气味气体放出:_______________________________________________。
2. 写出下列反应的离子方程式
3. 钠的制取及保存(1)制取:(2)保存:密封保存,通常保存在_______________________中。
①钠钾合金(液态)可用于原子反应堆的导热剂。②用作电光源,制作高压钠灯。③冶炼某些金属。
物理性质:NaOH的俗名为______、火碱或苛性钠;它是一种白色固体,____溶于水并放出大量的热;有吸水性,吸收空气中的水分而_____;有很强的腐蚀性。
2. 化学性质(1)具有碱的通性。(2)其他反应: 与金属单质反应:与非金属单质反应:
2Al+2NaOH+2H2O == 2NaAlO2 + 3H2 ↑
Cl2+2NaOH == NaCl + NaClO + H2O
3. 制取(1)实验室制取少量氢氧化钠的方法: Na2CO3+Ca(OH)2===_________________________(2)氯碱工业:
CaCO3↓+2NaOH
题组一:钠的性质及应用
(2018·广东汕头一模改编)下列关于金属钠的叙述正确的是( ) A. 金属钠可以保存在煤油或酒精中,防止在空气中变质 B. 金属钠着火时,可以用泡沫灭火器来灭火 C. 钠与氧气反应生成1 ml Na2O2时,转移电子数目为2NA D. 实验时用剩的钠块不应放回原试剂瓶
2. 按如图所示实验装置进行钠跟水反应的实验,据此判断下列 说法正确的是( )A.打开右端胶塞,将一小块金属钠加入到 煤油中,反应前片刻,钠的位置应在a处B.开始反应后,能观察到的实验现象是钠在 b处液面以下的水中反应C.反应一段时间后,左端液面上升,进入长颈 漏斗,a处有无色气体产生D.若用苯或酒精来代替煤油,可观察到相同的实验现象
题组二:氢氧化钠的性质
3. (2019·各地模拟试题重组)下列有关氢氧化钠性质和用途的 说法不正确的是( ) A. 实验室装氢氧化钠溶液的试剂瓶不能用玻璃塞 B. 在中和实验中,要用碱式滴定管装氢氧化钠标准液 C.实验室制备氯气可以用氢氧化钠溶液处理尾气 D.过量二氧化硫与氢氧化钠溶液反应生成亚硫酸钠
1. 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。完成下列计算:(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠__________g。
1. 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。完成下列计算:(2)钠钾合金可在核反应堆中用作热交换液。5.05 g钠钾合金溶于200 mL水生成0.075 ml氢气。①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化) ②计算并确定该钠钾合金的化学式。
② 设上述合金中含a ml Na、b ml K,则有: a+b=0.075×2, 23a+39b=5.05解得a=0.050、b=0.10,该钠钾合金化学式为NaK2。
2. (2015·上海卷)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
(1)写出电解饱和食盐水的离子方程式:__________________________________。(2)离子交换膜的作用: _____________________________、____________________。(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从 图中________位置流出。(填“a”“b”“c”或“d”)
能得到纯度更高的氢氧化钠溶液
避免Cl2与H2反应
第二节氧化钠、过氧化钠
1. 氧化钠和过氧化钠的比较
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
Na2O+2HCl=2NaCl+H2O
强氧化剂、漂白剂、供氧剂、消毒剂
题组一: Na2O2 的性质
1.比较下列四组反应,回答下列问题。一组:①Na2O2+CO2 ②Na2O2+SO2二组:③ Na2O2+FeCl3(溶液) ④Na2O2 +FeCl2(溶液)三组:⑤NaOH溶液滴入紫色石蕊试液中 ⑥Na2O2固体加入到紫色石蕊试液中(1)写出①、②两反应的化学方程式。(2)判断③、④反应中可能发生的现象,为什么?(3)判断⑤、⑥反应中可能发生的现象?
过氧化钠的强氧化性和还原性
(1)强氧化性的具体表现
可以用来漂白织物、麦秆、羽毛等
与 SO2或SO32—
(2)遇KMnO4等强氧化剂时,表现出还原性,氧化产物为O2
(3)遇CO2、H2O、H+则发生自身的氧化还原反应。
变式1:根据Na2O2的强氧化性与还原性完成下列化学方程式:(1)向氢硫酸饱和溶液中加入少量Na2O2:____________________。(2)向Na2SO3溶液中加入少量Na2O2:_______________________。
【答案】(1)Na2O2+H2S = S↓+2NaOH(2)Na2O2+Na2SO3+H2O = Na2SO4+2NaOH
变式:下列反应与 Na2O2+SO2 = Na2SO4 相比较, Na2O2 的作用相同的是 。
① 2Na2O2+2CO2=2Na2CO3+O2
② 2Na2O2+2SO3 = 2Na2SO4+O2
③ Na2O2+H2SO4 = Na2SO4+H2O2
④ 3Na2O2+Cr2O3 = 2Na2CrO4+Na2O
题组二: Na2O2 与H2O、CO2反应的定量分析
1. 200 ℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2 充分反应后固体质量增加了3.6 g,则原混合气体的总物质的 量是( ) A. 0.125 ml B. 0.25 ml C. 0.5 ml D. 1 ml
2.(2018·安徽宿州模拟)在一密闭容器中有CO、H2、O2共16.5 g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重7.5 g,则原混合气体中O2的质量分数是( ) A.54.5% B.40% C.36% D.33.3%
Na2O2的与H2O、CO2反应的定量关系
(2017·深圳三校联考)甲同学将Na2O2分别与H2O和浓盐酸反应,有如下现象:
实验Ⅰ中:(1) 该反应是________(填“放热”或“吸热”)反应。
(2)反应的化学方程式是______________________________。(3)证明无色无味气体是氧气的方法是____________________________________________。
2Na2O2+2H2O=4NaOH+O2↑
将带火星的木条伸入试管,复燃则证明是氧气
实验Ⅱ中:(4) 根据现象②、③,推测生成的气体中可能含有Cl2,产生Cl2的化学方程式是__________________________________________。(5) 若往“浅黄绿色溶液”中加入FeCl3溶液,立即产生与实验Ⅰ相同的气体,原因是_______________________________________。
Na2O2+4HCl(浓)=2NaCl+Cl2↑+2H2O
浅黄绿色溶液中存在H2O2,加入FeCl3使H2O2分解速率加快,立即产生氧气
第三节碳酸钠、碳酸氢钠
1. 碳酸钠和碳酸氢钠的比较
两者均易溶于水,Na2CO3溶解度 NaHCO3溶解度
两者均为强碱弱酸盐,水溶液呈碱性
同温度同浓度时,溶液碱性Na2CO3 NaHCO3
(2)碳酸钠和碳酸氢钠的化学性质比较
Na2CO3+HCl = NaCl+NaHCO3(盐酸少量)
Na2CO3+2HCl = 2NaCl+H2O+CO2↑(盐酸足量)
碳酸氢钠:NaHCO3+HCl = NaCl+H2O+CO2↑
② 与NaOH溶液反应
Na2CO3与NaOH 溶液不反应
NaHCO3+NaOH = Na2CO3+H2O
Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH
2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
【练习】 写出NH4HCO3溶液与少量NaOH、足量NaOH反应的离子方程式
碳酸钠受热不分解,稳定,
Na2CO3+H2O+CO2↑
(3)碳酸钠和碳酸氢钠的相互转化
① CO2+H2O;
①固体,加热;
2. 碳酸钠和碳酸氢钠的用途
(1)Na2CO3用于玻璃、肥皂、合成洗涤剂、造纸、纺织、 石油、冶金等工业中
(2)NaHCO3是灭火器,发酵粉的主要成分之一;在医疗上, 是治疗胃酸过多的一种药剂。
3. Na2CO3的制备——侯氏制碱法
首先配制出饱和NaCl溶液,然后依次向溶液中通入足量的______和足量的__________,此时会有晶体析出,过滤得到NaHCO3固体,最后将所得固体加热分解即得到纯碱。
NaCl+NH3+CO2+H2O = NaHCO3+NH4Cl
题组一:Na2CO3和NaHCO3的性质、用途和制备
1.下列说法正确的是( )A.(2017•天津卷,4A)除去NaHCO3固体中的Na2CO3,可将 固体加热至恒重B.(2016•全国卷Ⅲ,7A)Al2(SO4)3和小苏打反应可用作泡沫灭 火器灭火C.(2016•天津卷,1B)碳酸氢钠药片是抗酸药,服用时喝些醋 能提高药效D.(2015•全国卷Ⅱ,10B) 1 L 0.1 ml•L-1的NaHCO3溶液中 HCO3-和CO32-离子数之和为0.1NA
题组一:Na2CO3和NaHCO3的性质、用途
2.(2018·山东定陶一中月考)化学无处不在,下列与化学有关 的说法不正确的是( )A.侯氏制碱法的工艺过程中应用了物质溶解度的差异B.用氢氟酸雕刻工艺玻璃上的纹饰C.Na2O可用于呼吸面具中作为氧气的来源D.黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成
3. 将Na2O、Na2O2、Na和足量NaHCO3的混合物置于密闭容器中充分加热,经足够长的时间后排放出所有气体物质,则最终残留的固体物质是( ) A.Na2O2与Na2CO3 B.Na2CO3 C.NaOH和Na2CO3 D.Na2CO3、Na2O2、NaOH
题组二:Na2CO3和NaHCO3的鉴别与除杂
4.(2019·山西太原二中周测)为鉴别K2CO3和NaHCO3两种白色 固体,有4位同学分别设计了下列四种不同的方法,其中不可 行的是( )A.分别滴入1 ml·L-1的盐酸,看气泡产生的快慢B.分别取样在试管中加热,将可能产生的气体通入澄清石灰水 中,观察有无白色浑浊C.分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀D.分别配成溶液,做焰色反应实验,观察火焰的颜色
5.为除去括号内的杂质,所选用的试剂或方法不正确的是( ) A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液 B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体 C.Na2O2粉末(Na2O),将混合物在氧气中加热 D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
1. Na2CO3和NaHCO3的鉴别
2. Na2CO3和NaHCO3的除杂
题组三: Na2CO3和NaHCO3与酸反应的原理和计算
6.(2019·云南大理月考)有关NaHCO3和Na2CO3的性质,以下叙 述错误的是( )A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下 Na2CO3产生的CO2体积小B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的 体积Na2CO3是NaHCO3的两倍C.等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸多D.等物质的量的NaHCO3和Na2CO3与足量盐酸反应产生CO2一 样多
7. 向NaOH和Na2CO3混合溶液中滴加0.1 ml·L-1稀盐酸,CO2 的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正 确的是( )A.在0~a范围内,只发生中和反应B.a=0.3C.ab段发生反应的离子方程式为 CO+2H+===H2O+CO2↑D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
依据图像特点判断溶液成分的方法
相关课件
这是一份高中化学人教版 (2019)必修 第一册第一节 钠及其化合物背景图课件ppt,共20页。PPT课件主要包含了NaCl,钠的物理性质,铁的物理性质,钠的化学性质,钠和氧气反应,思考讨论,钠与水反应,浮游溶响红,实验现象,金属钠的性质等内容,欢迎下载使用。
这是一份高中化学第二章 海水中的重要元素——钠和氯第一节 钠及其化合物精品ppt课件,共60页。PPT课件主要包含了活泼的金属单质钠,如果要研制钠电池,我们要从哪里入手,的总储量可达4亿亿吨,NaCl,钠的工业制备,Na+,Na+H2O→,OH-,你观到哪些现等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第一节 钠及其化合物授课ppt课件,共29页。PPT课件主要包含了导入新课,海水晒盐,海洋生物,钠与氧气的反应,钠与水的反应,相关链接,课堂小结,达标检测等内容,欢迎下载使用。










