

第四章 物质结构与元素周期律 第三节化学键训练题-2021年高一上学期(29019人教版必修一)
展开第四章 物质结构与元素周期律 第三节化学键训练题
时间:75分钟 100分
一、单选题(每题3分,共45分)
1.下列化学用语表达正确的是
A.HCl的电子式:
B.用电子式表示NaCl的形成过程:
C.Na2O2的电子式:
D.水的电子式:
2.下列化合物中,既存在离子键又存在共价键的是
A.KOH B.CO2 C.NaCl D.HCl
3.下列说法正确的是
A.氢元素和其他元素可形成共价化合物,也可形成离子化合物
B.离子化合物中只含离子键,共价化合物中只含共价键
C.碘晶体升华、HCl气体溶于水都有共价键被破坏
D.NaCl晶体中,Na+和Cl-之间通过静电引力形成离子键
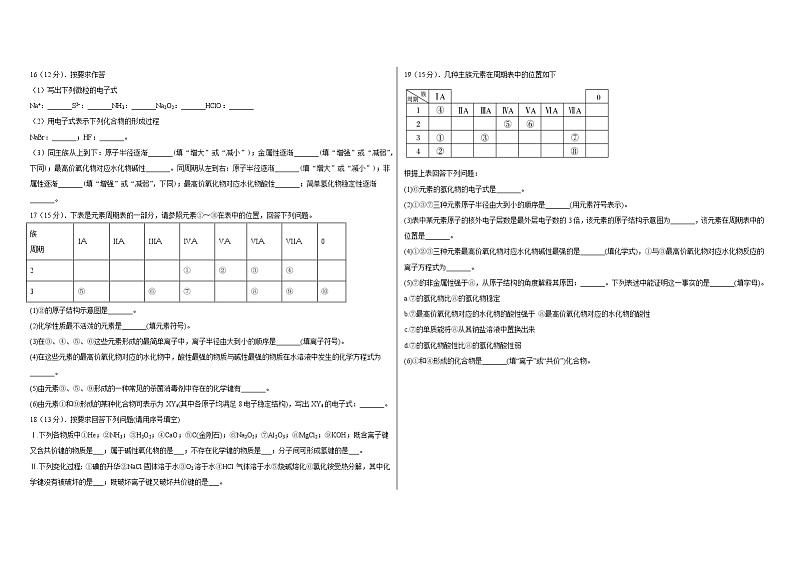
4.水煤气变换反应的过程如图所示。下列说法不正确的是
A.过程I、II中均有氧氢键断裂
B.该反应的化学方程式是CO+H2OCO2+H2
C.H2O和CO2分子中均含有共价键
D.该反应反应物中的化学键全部断裂形成原子,原子再重新结合生成生成物
5.用中子轰击原子产生a粒子(即氦核的核反应为:+→+。已知元素Y在化合物中呈+1价。下列说法不正确的是
A.H3XO3可用于中和溅在皮肤上的NaOH溶液
B.Y单质在空气中燃烧的产物是Y2O2
C.X和氢元素形成共价化合物
D.6Y和7Y互为同位素
6.下列过程中,共价键被破坏的是
①溴蒸气被木炭吸附
②石英熔化
③酒精溶于水
④气体溶于水
⑤碘升华
⑥受热分解
⑦氢氧化钠熔化
⑧溶于水
A.②④⑥ B.④⑤⑥ C.①④⑧ D.①④⑥
7.下列关于离子化合物的说法正确的是
A.离子化合物一定能导电
B.离子化合物不一定易溶于水
C.能导电的物质一定是离子化合物
D.溶于水能导电的化合物一定是离子化合物
8.下列叙述错误的是
①热稳定性:
②最外层两个电子的元素不一定在第ⅡA族
③晶体溶于水时,离子键被破坏,共价键不受影响
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤金刚石和石墨互为同素异形体,熔点和硬度都很高
⑥氯的各种含氧酸的酸性由弱到强排列为
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键
A.②④⑥⑦ B.①⑤⑥⑦ C.②③④⑤ D.①③⑤⑦
9.短周期主族元素X、Y、Z、W的原子序数依次增大、且总和为24,由四种元素组成的某化合物结构如图所示,具有良好的储氢性能,下列有关叙述错误的是
A.原子半径由大到小的顺序:
B.简单气态氢化物稳定性:
C.该化合物中,X、Y、Z之间均为共价键
D.Z的最高价氧化物对应的水化物为强酸
10.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为,单质Z在空气中燃烧有黄色火焰,W—的最外层为8电子结构。下列说法正确的是
A.简单氢化物的稳定性:
B.原子半径大小;
C.Z与Y形成的化合物都只含离子键
D.化合物可作漂白剂和消毒剂
11.W、X、Y、Z是原子序数依次增大的四种短周期主族元素,X与Y位于同一主族,X与W能形成多种二元化合物,其中一种常温下为红棕色气体,Y与Z形成的化合物Y2Z2的球棍模型为。下列叙述不正确的是
A.最高价氧化物对应水化物酸性:W
C.Y2Z2中所有原子最外层均满足8电子稳定结构
D.常温下Z的单质与W的简单氢化物相遇可能产生白烟
12.下列说法正确的是
A.过氧化氢分子中既含极性键又含非极性键
B.干冰气化时吸收的热量用于克服分子内碳、氧原子间的作用力
C.氯化氢和氯化钠溶于水都能电离出Cl-,所以氯化氢和氯化钠均是离子化合物
D.CO2和H2O分子中所有原子的最外电子层都具有8电子的稳定结构
13.下列相关微粒的化学用语正确的是
A.中子数为8的碳原子:
B. NH3的电子式:
C.氧原子的结构示意图:
D.CO2的比例模型(空间充填模型):
14.实验室利用NH4Cl固体和Ca(OH)2固体反应制氨气,反应方程式为:,下列关于该反应的说法错误的是
A.NH4Cl中存在离子键和极性键
B.此反应过程中既有离子键、极性键断裂,也有离子键和极性键形成
C.1 mol Ca(OH)2含2 mol H-O键,1 mol NH3含3 molN-H键
D.像Ca(OH)2、CaCl2这样含金属元素的化合物一定属于离子化合物
15.我国嫦娥五号探测器带回的月球土壤,经分析发现其构成与地球土壤类似土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族,下列结论正确的是
A.原子半径大小顺序为
B.化合物XW中的化学键为离子键
C.Y单质的导电性能弱于Z单质的
D.Z的氧化物的水化物的酸性强于碳酸
二、填空题
16(12分).按要求作答
(1)写出下列微粒的电子式
Na+:_______S2-:_______NH3:_______Na2O2:_______HClO:_______
(2)用电子式表示下列化合物的形成过程
NaBr:_______;HF:_______。
(3)同主族从上到下:原子半径逐渐_______(填“增大”或“减小”);金属性逐渐_______(填“增强”或“减弱”,下同);最高价氧化物对应水化物碱性_______。同周期从左到右:原子半径逐渐_______(填“增大”或“减小”);非属性逐渐_______(填“增强”或“减弱”,下同);最高价氧化物对应水化物酸性_______;简单氢化物稳定性逐渐_______。
17(15分).下表是元素周期表的一部分,请参照元素①~⑩在表中的位置,回答下列问题。
族
周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
2
①
②
③
④
3
⑤
⑥
⑦
⑧
⑨
⑩
(1)②的原子结构示意图是_______。
(2)化学性质最不活泼的元素是_______(填元素符号)。
(3)在③、④、⑤、⑥这些元素形成的最简单离子中,离子半径由大到小的顺序是_______(填离子符号)。
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生的化学方程式为_______。
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有_______。
(6)由元素①和⑨形成的某种化合物可表示为XY4(其中各原子均满足8电子稳定结构),写出XY4的电子式:_______。
18(13分).按要求回答下列问题(请用序号填空)
Ⅰ.下列各物质中①He;②NH3;③H2O2;④CaO;⑤C(金刚石);⑥Na2O2;⑦Al2O3;⑧MgCl2;⑨KOH;既含离子键又含共价键的物质是___;属于碱性氧化物的是___;不存在化学键的物质是___;分子间可形成氢键的是___。
Ⅱ.下列变化过程:①碘的升华②NaCl固体溶于水③O2溶于水④HCl气体溶于水⑤烧碱熔化⑥氯化铵受热分解,其中化学键没有被破坏的是___;既破坏离子键又破坏共价键的是___。
19(15分).几种主族元素在周期表中的位置如下
根据上表回答下列问题:
(1)⑥元素的氢化物的电子式是_______。
(2)①③⑦三种元素原子半径由大到小的顺序是_______(用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_______,该元素在周期表中的位置是_______。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是_______(填化学式),①与③最高价氧化物对应水化物反应的离子方程式为_______。
(5)⑦的非金属性强于⑧,从原子结构的角度解释其原因:_______。下列表述中能证明这一事实的是_______(填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于 ⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
(6)①和④形成的化合物是_______(填“离子”或“共价”)化合物。
参考答案
1.D
【详解】
A.氮原子的最外层有5个电子,故氨气的电子式为,故A错误;
B.用电子式表示 NaCl 的形成过程中间用→,不用=,故B错误;
C.过氧化钠为离子化合物,两个氧原子通过共用1对电子结合在一起,核外满足8电子结构,电子式为,故C错误;
D.水为共价化合物,水分子的电子式为,故D正确;
故选:D。
2.A
【详解】
A.KOH是离子化合物,K+、OH-之间以离子键结合,在OH-中H与O原子之间以共价键结合,故KOH中含有离子键、共价键,A符合题意;
B.CO2是共价化合物,在CO2分子中,C原子与2个O原子之间形成4个共价键,使分子中各原子都达到8个电子的稳定结构,只存在共价键,不存在离子键,B不符合题意;
C.NaCl是离子化合物,Na+、Cl-之间以离子键结合,不存在共价键,C不符合题意;
D.HCl是共价化合物,H原子与Cl原子之间以共价键结合,不存在离子键,D不符合题意;
故合理选项是A。
3.A
【详解】
A. 氢元素和其他元素可形成共价化合物例如氯化氢、水等,也可形成离子化合物例如NaH等,A正确;
B.只要含有离子键的化合物都是离子化合物、离子化合物中也可以有共价键、例如氢氧化钠、铵盐等既有离子键、又有共价键,共价化合物中只含共价键,B错误;
C.碘晶体升华时克服的是分子间的作用力、HCl气体溶于水共价键被破坏,C错误;
D. NaCl晶体中,Na+和Cl-之间通过静电作用形成离子键,静电作用包括吸引力和排斥力, D错误;
答案选A。
4.D
【详解】
A. 由图知,过程I、II中均有氧氢键断裂,A正确;
B.由图知,反应物为CO、H2O,生成物为CO2和H2,则反应的化学方程式是CO+H2OCO2+H2,B正确;
C. H2O分子中为氢氧键、CO2分子中为碳氧双键,均为共价键,C正确;
D. 由图知,CO分子内的化学键没有断裂形成原子, D不正确;
答案选D。
5.B
【详解】
根据守恒规律可知,Z+0=3+2=5,得Z=5,即X原子中质子数为5,X为B原子,Y原子中质子数为3,Y为Li原子。
A.NaOH溶液具有强碱性,能够腐蚀皮肤,若少量NaOH溶液溅在皮肤上,应立即用大量流动水冲洗,然后涂上H3BO4溶液,故A正确;
B.Li单质在空气中燃烧的产物是Li2O,故B错误;
C.B元素为非金属元素,其与H元素形成的BH3化合物为共价化合物,故C正确;
D.6Li和7Li原子中质子数相同,二者的中子数不同,因此二者互为同位素,故D正确;
综上所述,不正确的是B项,故答案为B。
6.A
【详解】
①溴蒸气被木炭吸附,是物理变化,共价键不被破坏,故不选;
②石英熔化过程中共价键被破坏,故选;
③酒精溶于水,不能发生电离,共价键不被破坏,故不选;
④HCl气体溶于水电离成H+和Cl-,共价键被破坏,故选;
⑤碘升华,破坏分子间作用力,共价键不被破坏,故不选;
⑥NH4Cl受热分解生成氨气和氯化氢,存在离子键和共价键的破坏,故选;
⑦氢氧化钠熔化破坏离子键,故不选;
⑧溶于水破坏离子键,故不选;
故选A。
7.B
【详解】
A.离子化合物不一定能导电,如固体氯化钠不导电,离子化合物在熔融状态下能导电,故A错误;
B.离子化合物不一定易溶于水,如碳酸钙是离子化合物,但碳酸钙难溶于水,故B正确;
C.能导电的物质不一定是离子化合物,如金属铜能导电,故C错误;
D.溶于水能导电的化合物不一定是离子化合物,如氯化氢是共价化合物,氯化氢的水溶液能导电,故D错误;
选B。
8.D
【详解】
①氢化物的热稳定性与非金属性有关,非金属性越强,其氢化物越稳定,非金属性,稳定性:,故错误;
②可能是He,位于0族,也可能在副族等,故正确;
③NaHSO4溶于水的电离方程式为,则离子键、共价键均被破坏,故错误;
④根据元素周期表,ⅢB族到ⅡB族,属于过渡元素,过渡元素都属于金属元素,故正确;
⑤金刚石为原子晶体,熔点和硬度都很高,而石墨为混合型晶体,熔点很高,但硬度较小,故错误;
⑥同一种元素的含氧酸,该元素的化合价越高,其含氧酸的酸性越强,即酸性,故正确;
⑦含有金属元素的化合物不一定含有离子键,如含有共价键,不含离子键,故错误;
综上所述,①③⑤⑦错误;故选:D。
9.B
【分析】
由图示可知,X形成单键,故X为H,其中Y、Z、W序数依次增大且X、Y、Z总序数为23,平均序数大于7,W形成W+,所以W为Na,Y和Z原子序数相加等于12,Z形成三个单键,故Z为N,Y为B,综上分析可知X、Y、Z、W分别为H、B、N、Na。
【详解】
A.电子层数越多半径越大,电子层数相同时最外层电子数越多半径越大,故原子半径:Na>B>N>H,即W>Y>Z>X,A正确;
B.同周期从左往右,非金属性逐渐增强,气态氢化物稳定性逐渐增强,所以稳定性:Z>Y,B错误;
C.由化合物的结构示意图可知,该化合物中H、B、N之间均以共用电子对即共价键结合,C正确;
D.Z为N,N的最高化合价氧化物的水化物为硝酸,硝酸是强酸,D正确;
故选B
10.D
【分析】
短周期主族元素X、Y、Z、W的原子序数依次增大,单质Z在空气中燃烧有黄色火焰,则Z为Na元素;W—的最外层为8电子结构,则W为Cl元素;X原子最外层电子数是其电子层数的2倍,则X为C元素;X、Y的核电荷数之比为, 则Y为O元素。
【详解】
A.元素的非金属性越强,简单氢化物的稳定性越强,氧元素的非金属性强于碳元素,则甲烷的稳定性弱于水,故A错误;
B.同周期元素,从左到右原子半径依次减小,则碳原子的原子半径大于氧原子,钠原子的原子半径大于氯原子,故B错误;
C.钠元素和氧元素形成的离子化合物可以是过氧化钠,其含有离子键和共价键,故C错误;
D.次氯酸钠具有强氧化性,常用作漂白剂和消毒剂,故D正确;
故选D。
11.A
【分析】
X与W能够形成多种二元化合物,其中一种常温下为红棕色气体,即NO2,X的原子序数大于W,W为N,X为O,X与Y位于同一主族,故Y为S,则Z为Cl。
【详解】
A.O元素无最高价氧化物,故A错误;
B.S原子与Cl原子的电子层数相同,同周期主族元素从左至右原子半径逐渐减小,因此原子半径:Y>Z,故B正确;
C.S2Cl2的电子式为,S、Cl原子均满足8电子稳定结构,故C正确;
D.常温下Cl2能与NH3发生氧化还原反应生成NH4Cl和N2,反应现象为产生白烟,故D正确;
综上所述,答案为A。
12.A
【详解】
A. 过氧化氢分子中既含O-H极性键又含O-O非极性键,故A正确;
B. 干冰气化时吸收的热量用于克服分子间的作用力,故B错误;
C. 氯化氢和氯化钠溶于水都能电离出Cl-,但氯化氢只含共价键是共价化合物、氯化钠是离子化合物,故C错误;
D. H2O分子中H原子的最外电子层具有2电子的稳定结构,故D错误;
故选A。
13.D
【详解】
A.碳元素的质子数为6,中子数为8,则质量数为14,此碳原子符号为,A不正确;
B.NH3属于共价化合物,N、H原子间形成共价单键,且N原子的最外层还有1对孤对电子,电子式为,B不正确;
C.氧原子的核电荷数为8,核外电子数为8,则原子结构示意图为,C不正确;
D.CO2分子为共价分子,三个原子在一条直线上,比例模型(空间充填模型)为,D正确;
故选D。
14.D
【详解】
A.NH4Cl是离子化合物,与Cl-通过离子键结合,在阳离子中N、H原子之间以极性共价键结合,故NH4Cl中存在离子键和极性键,A正确;
B.在该反应发生时,既有反应物中离子键、极性共价键的断裂,也有生成物中离子键、极性共价键的形成,B正确;
C.Ca(OH)2是离子化合物,在OH-中含有H-O共价键,在1个Ca(OH)2中含有2个H-O键,则在1 mol Ca(OH)2含2 mol H-O键;在1个NH3中含有3 个N-H键,则在1 mol NH3含3 mol N-H键,C正确;
D.含有金属元素的化合物不一定是离子化合物,如AlCl3是共价化合物,D错误;
故合理选项是D。
15.B
【分析】
由短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15, X、Y、Z为同周期相邻元素,可知W所在主族可能为第ⅢA族或第ⅥA族元素,又因X、Y、Z为同周期相邻元素,且均不与W同族,故W一定不是第ⅢA族元素,即W一定是第ⅥA族元素,进一步结合已知可推知W、X、Y、Z依次为O、Mg、Al、Si,据此答题。
【详解】
A.O原子有两层,Mg、Al、Si均有三层且原子序数依次增大,故原子半径大小顺序为Mg>Al>Si>O,即,A错误;
B.化合物XW即MgO为离子化合物,其中的化学键为离子键,B正确;
C.Y单质为铝单质,铝属于导体,导电性很强,Z单质为硅,为半导体,半导体导电性介于导体和绝缘体之间,故Y单质的导电性能强于Z单质的,C错误;
D.Z的氧化物的水化物为硅酸,硅酸酸性弱于碳酸,D错误;
故选B。
16.
(1) Na+
(2)
(3) 增大 增强 逐渐增强 减小 增强 逐渐增强 增强
【分析】
(1)
Na+的电子式就是离子符号,即Na+;S2-的电子式为;NH3是共价化合物,电子式为;Na2O2是含有共价键的离子化合物,电子式为;HClO是共价化合物,电子式为;
(2)
NaBr是离子化合物,其形成过程可表示为;HF是共价化合物,其形成过程可表示为。
(3)
同主族从上到下原子半径逐渐增大;原子核对最外层电子的吸引力逐渐减小,金属性逐渐增强;最高价氧化物对应水化物碱性逐渐增强。同周期从左到右原子半径逐渐减小;原子核对最外层电子的吸引力逐渐增强,非属性逐渐增强;最高价氧化物对应水化物酸性逐渐增强;简单氢化物稳定性逐渐增强。
17. Ar O2->F->Na+>Al3+ NaOH+HClO4=NaClO4+H2O 共价键、离子键
【分析】
根据元素在周期表中的位置,①是C、②是N、③是O、④是F、⑤是Na、⑥是Al、⑦是Si、⑧是S、⑨是Cl、⑩是Ar。
【详解】
(1)②是N元素,N原子结构示意图是;
(2) Ar最外层有8个电子,既不易得电子又不易失电子,化学性质最不活泼的元素是Ar;
(3) O2-、F-、Na+、Al3+电子层数相同,质子数越多半径越小,离子半径由大到小的顺序是O2->F->Na+>Al3+;
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质是HClO4,碱性最强的物质是NaOH,在水溶液中发生的化学方程式为NaOH+HClO4=NaClO4+H2O;
(5)由元素O、Na、Cl形成的一种常见的杀菌消毒剂是NaClO,存在的化学键有共价键、离子键;
(6)由元素C和Cl形成的化合物是CCl4,CCl4是共价化合物,电子式为。
18.⑥⑨ ④ ① ②③ ①③ ⑥
【详解】
Ⅰ.①He为单原子分子,不存在化学键;
②NH3含有极性共价键,分子间存在氢键;
③H2O2含有极性共价键和非极性共价键,分子间存在氢键;
④CaO为离子化合物,只存在离子键,为碱性氧化物;
⑤C(金刚石)含有非极性共价键;
⑥Na2O2为离子化合物,存在离子键和非极性共价键,为过氧化物;
⑦Al2O3为离子化合物,只存在离子键,为良性氧化物;
⑧MgCl2为离子化合物,只存在离子键;
⑨KOH为离子化合物,存在离子键和极性共价键;
既含离子键又含共价键的物质是⑥⑨;属于碱性氧化物的是④;不存在化学键的物质是①;分子间可形成氢键的是②③;
Ⅱ.①碘的升华为物理变化;
②NaCl固体溶于水,离子键被破坏;
③O2溶于水为物理变化;
④HCl气体溶于水,共价键被破坏;
⑤烧碱熔化,离子键被破坏;
⑥氯化铵受热分解生成氨气和氯化氢,离子键、共价键被破坏;
化学键没有被破坏的是①③;既破坏离子键又破坏共价键的是⑥。
19. Na>Al>Cl 第三周期ⅠA族 KOH OH-+Al(OH)3=+2H2O Cl、Br处于同一主族(ⅦA族),易得1个电子,Cl的原子半径比Br小,原子核对最外层电子的吸引能力强,Cl的得电子能力强,非金属性强 abc 离子
【分析】
根据元素在周期表中的相对位置可知各元素是:①Na、②K、③Al、④H、⑤C、⑥N、⑦Cl、⑧Br。
【详解】
(1)⑥是N元素,最低负价-3价,氢化物是NH3,电子式为;
(2)①③⑦三种元素处于第3周期,从左到右原子半径逐渐减小,原子半径由大到小的顺序是Na>Al>Cl;
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,则为Na元素,原子结构示意图为,Na元素在周期表中的位置是第三周期IA族;
(4)①②③三种元素的金属性K>Na>Al,①②③三种元素氧化物对应水化物碱性KOH>NaOH>Al(OH)3,最强的是KOH;NaOH为强碱,Al(OH)3为两性氢氧化物,二者反应生成偏铝酸钠和水,离子方程式为OH-+Al(OH)3=+2H2O;
(5)⑦非金属性强于⑧,从原子结构的角度解释其原因为Cl、Br处于同一主族(VIIA族),易得1个电子,Cl的原子半径比Br小,核对最外层电子的吸引能力强,Cl的得电子能力强,非金属性强;
a.非金属性越强氢化物越稳定,故a符合题意;
b.非金属性越强最高价氧化物的水化物的酸性越强,故b符合题意;
c.⑦能将⑧从其钠盐溶液中置换出来,说明氧化性Cl2>Br2,证明非金属性Cl>Br,故c符合题意;
d.氢化物的酸性强弱与非金属性强弱无关,故d不符合题意;
故选a、b、c。
(6)①和④形成的化合物为NaH,为离子化合物。
高中人教版 (2019)第四章 物质结构 元素周期律第三节 化学键第1课时当堂达标检测题: 这是一份高中人教版 (2019)第四章 物质结构 元素周期律第三节 化学键第1课时当堂达标检测题,共4页。试卷主要包含了下列说法错误的是,X元素原子最外层有7个电子等内容,欢迎下载使用。
高中沪科版(2020)元素周期律随堂练习题: 这是一份高中沪科版(2020)元素周期律随堂练习题,共11页。试卷主要包含了单选题,填空题,元素或物质推断题,多选题等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键达标测试: 这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键达标测试,共5页。












