





化学必修 第二册第二节 化学反应的速率与限度多媒体教学ppt课件
展开
这是一份化学必修 第二册第二节 化学反应的速率与限度多媒体教学ppt课件,共42页。PPT课件主要包含了几个间接判据,答案C,答案A等内容,欢迎下载使用。
第2课时化学反应的限度 化学反应条件的控制
一、化学反应的限度1.可逆反应。(1)定义:在同一条件下 正反应方向 和 逆反应方向 均能进行的化学反应。 (2)特点。①正向反应和逆向反应 同时 进行。 ②一定条件下,反应物不可能 全部 转化为生成物,即反应物的转化率不可能达到 100% 。
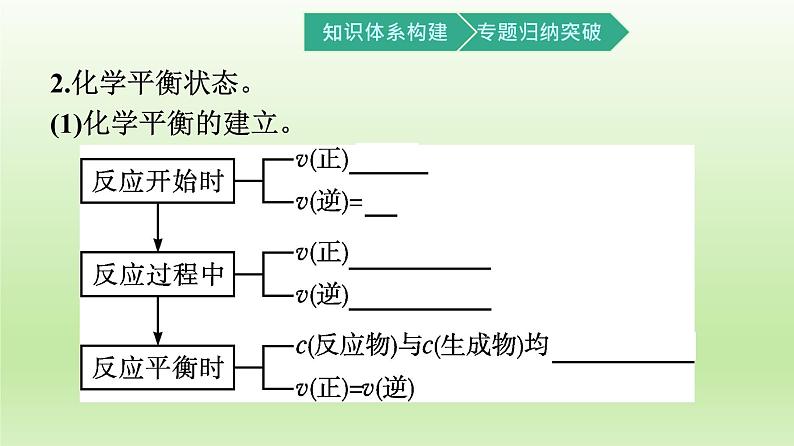
2.化学平衡状态。(1)化学平衡的建立。
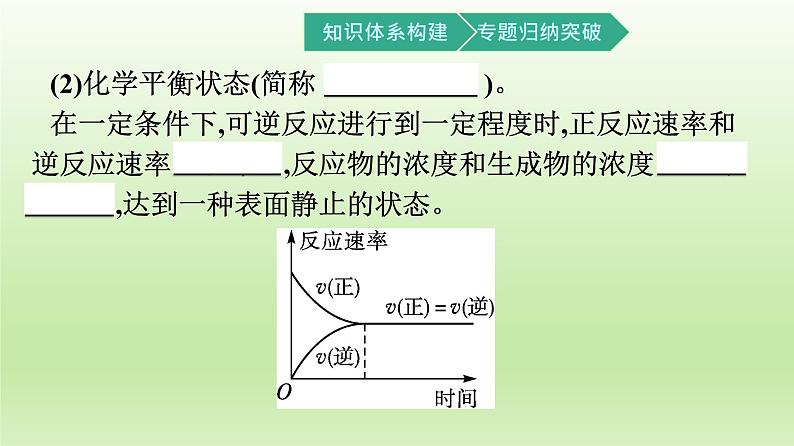
(2)化学平衡状态(简称 化学平衡 )。 在一定条件下,可逆反应进行到一定程度时,正反应速率和逆反应速率 相等 ,反应物的浓度和生成物的浓度 不再改变 ,达到一种表面静止的状态。
可逆反应在一定条件下达到化学平衡状态,此时反应物的转化率最大吗?提示:可逆反应在一定条件下达到化学平衡状态后,反应物的量不再随时间的变化而变化,因此反应物的转化率达最大值,且保持不变。
二、化学反应条件的控制1.化学反应条件的控制。
2.燃料燃烧的条件。(1)燃料与空气或氧气尽可能接触。(2)温度达到燃料的 着火点 。 3.提高燃料燃烧效率的措施。(1)尽可能使燃料充分燃烧,提高能量的转化率。关键是燃料与空气或氧气尽可能接触,且空气要 适当过量 。 (2)尽可能充分地利用燃料燃烧所释放出的热能,提高热能利用率。
一 化学平衡的建立和特征重难归纳1.化学平衡建立的速率图像。
2.化学平衡状态的特征概括为:逆、等、动、定、变。
化学平衡状态建立后,反应停止,反应速率为0,这句话对吗?提示:不对。化学平衡建立后,v(正)=v(逆)≠0,反应并没有停止。
典例剖析对于可逆反应M(g)+N(g) Q(g)达到平衡时,下列说法正确的是( )。A.M、N、Q三种物质的浓度一定相等B.M、N全部变成了QC.反应物和生成物的浓度都保持不变D.反应已经停止答案:C
解析:平衡时反应物、生成物的浓度之比应从两个方面考虑:一是反应物的起始浓度,二是化学方程式中的化学计量数。如2 ml M与1 ml N反应,无论怎样反应,M与N的浓度永远不相等,所以“M、N、Q三种物质的浓度一定相等”这种说法是错误的,A错误;此反应是可逆反应,B错误;反应物和生成物的浓度都保持不变,可以说明反应达到平衡状态,但反应未停止, C正确,D错误。
学以致用下列对化学反应速率与化学反应限度的叙述,不正确的是( )。A.当化学反应达到最大限度时反应速率为0B.同一化学反应,若反应条件不同,限度可能不同C.化学反应达到限度时,正、逆反应速率相等D.化学反应的限度与时间的长短无关答案:A
解析:反应达到最大限度时v(正)=v(逆)≠0,A项错误;同一化学反应,条件改变,化学平衡可能被破坏,反应限度可能就会被改变,B项正确;任何可逆反应都有一定的限度,当反应达到限度时,即反应达到化学平衡,此时v(正)=v(逆),对于同一可逆反应,达到化学平衡时,当外界条件不变时,反应的限度不变,与时间长短无关,C、D项正确。
二 化学平衡状态的判断重难归纳1.两个直接判据。(1)正反应速率和逆反应速率相等。(2)反应物和生成物的浓度不再变化。
特别提醒(1)根据正、逆反应速率来判断可逆反应是否达到平衡时,要注意达到平衡时同一种物质正、逆反应速率相等,不同种物质正、逆反应速率之比等于化学计量数之比。
(2)根据压强是否变化来判断可逆反应是否达到平衡时,要注意两点:一是容器的容积是否可变;二是反应前后气体的分子数是否变化。
(3)对于不同的反应,用相同物理量判断时,结果可能不同。如压强不再变化时,对于气体分子数变化的反应是平衡状态,但气体分子数不变的反应不一定是平衡状态。
(1)判断可逆反应已达到平衡状态的依据有哪些?提示:直接判据:a.正、逆反应速率相等;b.各物质的浓度不变。间接判据:各组分的百分含量、物质的量、压强、平均相对分子质量、密度、颜色不随时间改变。(2)如何理解正、逆反应速率相等?提示:同一物质的生成速率和消耗速率相等。
A.④⑤⑥B.③④⑥C.①③④D.②③⑥答案:B解析:由于反应前后气体的化学计量数关系未知,若该反应为m+n=p+q,则体系的压强始终为一定值,体系的压强不再改变,不能说明反应达到平衡,①错误;由于体系的体积一定,而气体的总质量不变,则密度始终为一定值,因此体系的密度不再改变,不能说明反应达到平衡,②错误;反应速率之比始终等于化学计量数之比,因此⑤错误。
⑦混合气体的平均相对分子质量不再改变的状态A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.①②③④⑤⑥⑦答案:A
解析:①中单位时间内生成n ml O2的同时必消耗2n ml NO2,知v(正)=v(逆),所以①能说明达到平衡状态;②所描述的都是指正反应方向的速率,无法判断;③无论达到平衡与否,用不同物质表示的反应速率之比等于化学方程式中各物质的化学计量数之比;④有色气体的颜色不变能够说明达到了化学平衡;因容器容积固定,密度是一个常数,所以⑤不能说明达到平衡状态;该反应是一个反应前后气体分子数不等的反应,容器的容积固定,所以⑥⑦均能说明达到平衡。
1.下列说法中不正确的是( )。A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等C.可以通过控制反应条件,使2 ml SO2与1 ml O2反应生成2 ml SO3D.化学反应的限度可以通过改变条件来改变答案:C
解析:在一定条件下,判断一个反应是否达到平衡,主要看正、逆反应速率是否相等,体系中各组分的浓度(或含量)是否保持不变。A项中,生成A2是逆反应,生成AB是正反应。显然v(正)
相关课件
这是一份化学必修 第二册第六章 化学反应与能量第二节 化学反应的速率与限度精品ppt课件,共36页。PPT课件主要包含了新课讲授,情景导入,化学反应快慢不同,千分之一秒即完成,百分之一秒即完成,救心丹,几分钟见效,钢铁腐蚀,若干年,几千万年以上等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度优质课件ppt,共30页。PPT课件主要包含了学习目标,思考讨论,新课讲授,减少量,增加量,常用单位min或s,典例分析,无法确定,三段式解题法,方法三段法等内容,欢迎下载使用。
这是一份高中化学第二节 化学反应的速率与限度获奖课件ppt,共60页。PPT课件主要包含了化学反应的限度,微判断,尝试解答,微训练,研习化学平衡等内容,欢迎下载使用。











